ハイライト
3重らせんβグルカンを認識する免疫システム
2011年07月11日
放射光を利用したタンパク質の構造解析は、免疫システムのしくみの解明にも役立っています。最近、フォトンファクトリーを利用して新たにわかった免疫システムは、「βグルカン」という多糖を異物として認識するしくみです。
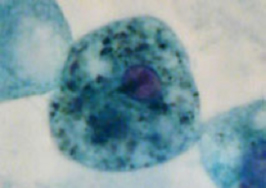
図1
マクロファージ
免疫応答を担うアメーバ状の細胞(写真中央)で、生体内に入った細菌などを捕食する。写真はマクロファージが黒く染色された異物を取り込んでいる様子を捉えたもの。
βグルカンを異物として認識する
人間をはじめ多くの個体が健康を維持できるのは「免疫」という生体防御システムが備わっているためです。身体の中に菌やウィルスのような異物が入ってきた時、それに立ち向かい、異物を退治する重要な役割を持っています。このシステムが正常に作動しないと菌やウィルスに感染したり、過剰な免疫応答による花粉症などのアレルギー症状が引き起こされます。
今回、解明に挑戦したのは、真菌類や植物の細胞壁に多く存在するβグルカンを認識する仕組みです。グルカンはグルコース(ブドウ糖)がたくさんつながってできた多糖で、βグルカンの「β」は隣のグルコースとのつながり方を表しています。結合するための手が上向きについているものをα結合、下向きについているものをβ結合と呼び、α結合でつながった多糖の代表的なものにデンプンがあります。
βグルカンは、人間をはじめとした哺乳類には存在しません。このβグルカンが生体内に入ると、感染細胞やガン細胞を攻撃するマクロファージ(図1)などを活性化させ、免疫力・抵抗力を高める作用があります。βグルカンはどのようにして生体内で認識され、免疫のスイッチを入れるのでしょうか。理化学研究所基幹研究所の山口芳樹(やまぐち・よしき)チームリーダー、金川真由美(かながわ・まゆみ)研究員、佐藤匡史(さとう・ただし)研究員(現名古屋市立大学)、東京薬科大学の大野尚仁(おおの・なおひと)教授、安達禎之(あだち・よしゆき)准教授らの研究グループは、生体内でβグルカンを認識する役目を担うタンパク質の立体構造から、認識のしくみを調べました。
βグルカンを認識する瞬間を捉える
画像提供:理化学研究所
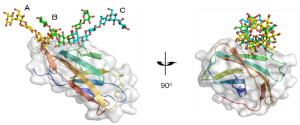
図2
βGRP/GNBP3が3本鎖βグルカンを認識する様子
3本のβグルカン鎖(A、B、C)が3重らせん様の構造を形成し、βGRP/GNBP3と相互作用している。βグルカン鎖と相互作用するβGRP/GNBP3上のアミノ酸残基は広範囲に分布している。
これまでの研究で、βグルカンは多糖の鎖が3本組で結合した3重らせん構造を取ることが知られていました。研究チームは、この3重らせん構造がβグルカン専用の受容体に認識される鍵と考え、βGRP/GNBP3という受容体タンパク質がβグルカンの3重らせん構造をしているものと特異的に結合しているかどうかを調べようと考えました。まず受容体タンパク質のうちのβグルカンと結合する部分(βグルカン結合ドメイン)を大量に作り、次にさまざまな種類や長さのβグルカン鎖との組み合わせを作り、約2,600通りの結晶化条件を調べました。この膨大な数の中から、受容体の結合ドメインとβグルカン鎖が結合しているものがあれば、それはまさに受容体がβグルカンを認識した瞬間を捉えたことになります。
ようやく結晶化に成功した受容体タンパク質とβグルカンの複合体の立体構造は、フォトンファクトリーの高性能タンパク質結晶構造解析ビームラインBL-5A、NW12A、NE3Aによって明らかになりました(図2)。
画像提供:理化学研究所
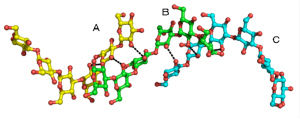
図3
3重鎖βグルカン鎖に見られる水素結合パターンの様子
βGRP/GNBP3のβグルカン結合ドメインと相互作用するβグルカン鎖は、1本のβグルカン鎖(B)が残りの2本のβグルカン鎖(AとC)と水素結合(点線)を形成しており、これまでの報告されてきたモデルをほぼ忠実に反映している。
画像提供:理化学研究所
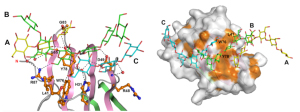
図4
広範囲にわたる多くのアミノ酸残基によって3重鎖βグルカンを認識する
(左)βGRP/GNBP3は、広範囲に分布するアミノ酸残基を利用してβグルカンの3本鎖全てを認識している。D49は2本のβグルカン鎖(BとC)と水素結合(点線)を形成している。
(右)βGRP/GNBP3の分子表面にある疎水性残基(オレンジ)の集まり。L41、W76、Y78を含む疎水性残基がβグルカンとの結合面を形成している。
3重らせんを面で認識
立体構造解析の結果、複合体を成しているβグルカンは擬似3重らせん構造をしており(図3)これまで報告されてきたモデルと良く一致していることが分かりました。やはり、3重らせん構造を特異的に見分けるしくみがどこかにありそうです。βグルカンと受容体が結合している部分を調べてみると、受容体の広範囲にわたって結合に携わるアミノ酸残基が存在していました。受容体は広い範囲を使って3本のβグルカン鎖全てを認識しているようです(図4)。
このことを検証するため、研究チームは結合に携わっていると考えられる7つのアミノ酸をそれぞれ変えた変異体を調製して、結合実験を行いました。すると、変異体の大部分は結合機能が低下することが分かりました。このことは、この7つのアミノ酸残基のいずれもが結合に重要であることを示しています。中でも49番目のアスパラギン酸(D49)は複数のグルカン鎖と相互作用しており、結合の要となっています。このように受容体が幅広い結合面を使って、3重らせんを形成しているβグルカン鎖の全ての鎖を認識するという、極めてユニークなしくみを持っていることが分かりました。
βグルカンは免疫調節剤として機能することが知られています。今回明らかになった3重らせん構造認識のしくみは、より合理的な薬剤設計への応用が見込まれています。また、βグルカンを検出するツールとして利用すれば、真菌感染症の診断やモニタリングなど医療分野でも応用が期待されています。
この研究成果は、米国の科学雑誌「The Journal of Biological Chemistry」のオンライン版6月22日に掲載されました。
![]() 毎週の記事のご案内をメールマガジン「news-at-kek」で配信します。
毎週の記事のご案内をメールマガジン「news-at-kek」で配信します。
詳しくは こちら をご覧ください。