トピックス
クライオ電顕とX線構造解析の組み合わせでアクチンの重合機構を解明
2010年11月2日
帝京大学の村上健次博士研究員、若林健之教授と産業技術総合研究所、九州工業大学の研究チームは、KEKフォトンファクトリーの放射光と、クライオ電子顕微鏡という2種類の構造解析法を組み合わせて、アクチン重合のしくみを明らかにしました。
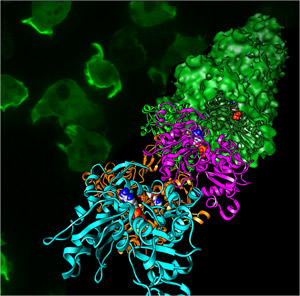
原子模型:村上健次、五味渕由貴、若林健之(帝京大学)
蛍光顕微鏡写真:野口太郎、上田太郎(産総研)
アクチンフィラメントの原子モデル(手前側のリボン模型)とクライオ電子顕微鏡像から再構成された立体像(奥側の表面模型)。
図中のアクチンフィラメントは手前側に優先的に伸び、その際に実体模型で示されているリン酸が結合を促進する。背景は細胞性粘菌で発現させたアクチンフィラメントの蛍光顕微鏡像であり、細胞が移動する先端に集中していることが見て取れる。
アクチンは、ミオシンとともに筋収縮を行なう他、細胞分裂や、神経繊維の伸長など、細胞のさまざまなダイナミックな動きに関わるタンパク質です。アクチンは球状のタンパク質で、これが多数重合してフィラメント状になり、運動や細胞の変形を起こしています。
研究グループは、生きた細胞・タンパク質を急速凍結して観察できるクライオ電子顕微鏡と、放射光を用いたX線結晶構造解析を組み合わせて、アクチン重合のしくみを捉えることを試みました。クライオ電子顕微鏡では、冷電界放出型電子銃(日立製作所)からの高コヒーレンス電子ビームや、エピタキシャル成長蛍光物質(浜松ホトニクス)を組み込んだCCDカメラによる検出系など、日本発の先端技術を駆使し、5オングストローム(1Å=1000万分の1mm)の分解能でアクチンフィラメントを観察することに成功しました。この結果、大型のアミノ酸や、アクチンフィラメントに結合したリン酸、アクチン分子にはさまれたマグネシウムイオンなどを可視化することに成功しました。
このクライオ電子顕微鏡像に、フォトンファクトリーPF-ARのNW12Aを使って調べた立体構造を重ね合わせることで、原子レベルでのアクチン重合のしくみを明らかにすることができました。
アクチンが関わる細胞分裂や細胞の運動は、がん細胞の浸潤、増殖、転移などにも関係するため、アクチン重合のしくみの解明は、新しいタイプのがん治療薬開発の可能性を拓きます。また神経細胞の伸長は記憶形成に関与するため、脳科学への寄与も期待されます。
この結果は2010年10月15日付けの米国科学誌Cellに掲載されました。