ハイライト
細胞が動く原動力、アクチン重合のしくみ
2010年12月14日
アクチンは、ミオシンとともに筋肉の収縮を行なうタンパク質として知られていますが、実は筋細胞だけでなく、私たちの体にある全ての細胞に含まれているタンパク質です。細胞の形を保ち、細胞が運動する力の元となる繊維状の構造を細胞骨格と呼びますが、この主成分の一つがアクチンが作る繊維、アクチンフィラメントです。筋肉の収縮はもちろんのこと、細胞分裂や、神経繊維の伸長など、細胞のさまざまな動きの多くはアクチンフィラメントが深く関わっています。
画像技術の進歩とともに
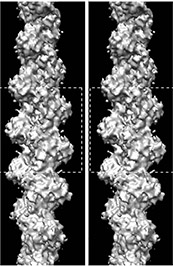
ここ最近、画像技術はハイビジョン、3D・・・と目覚ましく発展しています。画像を用いた分析を行なう研究者たちによってもその技術は進化を遂げ、それによって新たな事実が次々と明らかになっています。帝京大学の若林健之(わかばやし・たけゆき)教授は、40年以上も前から画像技術を駆使してアクチンの構造や機能を研究してきました。例えば3D画像。図1の左右の図が一つに重なるように見てください。すると立体的に見えてきます。このような手法を1970年代にすでに取り入れ、立体構造を明らかにしてきました。
図1に示したらせん状の構造がアクチンフィラメントです。アクチン1分子は球形のタンパク質ですが、それがビーズのようにつながり、まるで撚られた糸のように2重らせん状になっています。アクチンフィラメントは、ビーズ玉に相当する球形のアクチン分子がくっついたり離れたりしています。フィラメントの片方の端に玉がくっつき、逆側の端から玉が離れると、フィラメントは全体として一方向に進む運動をします。このように、アクチンが一方向に連なり伸びるという、細胞の運動の鍵を握る反応は、いったいどのようなしくみで起こるのでしょうか。これは若林教授の長年の研究テーマでもありました。
若林教授と研究室の村上健次博士研究員(現スタンフォード大)は、産業技術総合研究所の上田太郎副研究センター長、九州工業大学の安永卓生教授たちと共同研究のチームを組み、アクチンが連なる重合反応のしくみを調べようと考えました。研究チームが使ったのは、アクチンを急速に凍結して観察するクライオ電子顕微鏡です。細胞内と近い状態のアクチンを観察するため、マグネシウムとたっぷりのリン酸とが入った溶液中でアクチンフィラメントを急速凍結して観察しました。
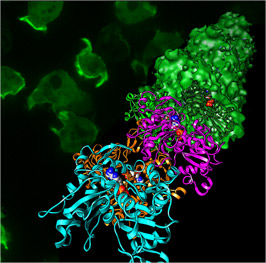
図2
アクチンフィラメントの原子モデル(手前側のリボン模型)とクライオ電子顕微鏡像から再構成された立体像(奥側の表面模型)。 図中のアクチンフィラメントは手前側に優先的に伸び、その際に実体模型で示されているリン酸が結合を促進する。背景の緑色の蛍光顕微鏡像は、細胞性粘菌で発現させたアクチンフィラメントの像であり、細胞が移動する先端に集中(明るい緑色の部分)していることが見て取れる。
顕微鏡などで非常に小さなものを見るときには、「分解能」という性能が重要になってきます。分解能は、どれぐらいの小さなものを見分けることができるか、という指標です。研究チームは、非常に質の良い電子ビームや、新しい検出システムを組み込んだ検出系など、日本の企業の最新の技術により分解能の向上を追求し、5オングストローム(1Å=1000万分の1mm、または1億分の1cm)の分解能でアクチンフィラメントを観察することに成功しました。その結果見えるようになった、アミノ酸、リン酸、マグネシウムイオンは、アクチンの重合に決定的な役割を果たしていたのです。
さらにこのしくみを原子レベルで詳しく調べるため、研究チームはKEKの放射光科学研究施設フォトンファクトリーPF-ARのNW12Aを使用してX線結晶構造解析を行いました。得られたアクチンフィラメントの立体構造を、クライオ電子顕微鏡で観察した像と重ねたのが図2です。
タンパク質の構造を放射光で観察するには、タンパク質を結晶化させなくてはなりません。結晶化させるときにカルシウムを入れるとアクチン分子が安定になるため、多くの研究者はカルシウムを使っていました。細胞内の状態と近い状態にするため、若林教授たちはカルシウムではなくマグネシウムを使いました。この変更、そして村上博士のアイディアにより上田研究室で作成されたATP分解を促進したり抑制したりするアクチン変異体が、半世紀以上解けなかった謎を解く決定的な役割を果たしました。
4世代の連携プレー
今回の研究でわかったしくみは次のようなものでした。アクチンフィラメントを形成している個々のアクチンに、世代順に1、2、3と仮に番号をつけて考えます(図3)。新たに0世代のアクチンがやってくると、まず真上にある2世代前のアクチンとくっつき、次に横の1世代前のアクチンとくっつき固定されます(図4)。ちょうどアクチンの凸と凹が合わさり、間にマグネシウムが入ることでさらに強固な結合となります。この時0世代のアクチンに1世代前のアクチンが寄ってゆくと真上にある3世代前のアクチンに手が届きやすくなり、手を伸ばすと3世代前のアクチンからもその一部である110番目のアミノ酸「ロイシン」が下りてきます。するとロイシンの隣のプロリンも一緒に下り、これまでプロリンに結合していた、同じ3世代前のアクチンにあるヒスチジンとの間にギャップができます(図5)。
画像提供:村上健次、若林健之(帝京大学)
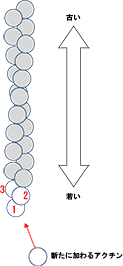
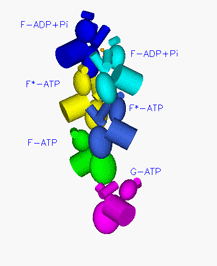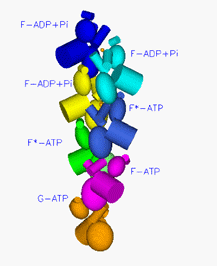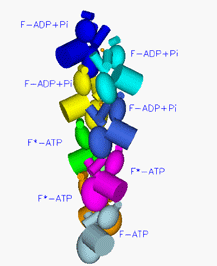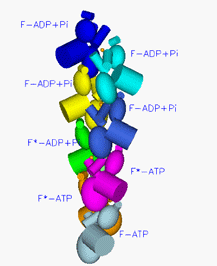
図3
アクチンフィラメントの模式図
球状で表した一粒がアクチン。これがらせん状に連なってアクチンフィラメントになる。この図ではアクチンフィラメントは下方向に伸び、下端から順に1世代前、2世代前、3世代前に結合したアクチンということを示す。
画像提供:村上健次、若林健之(帝京大学)
図4
アクチンが重合するしくみ(動画)
ピンクと青がまずくっつく。つぎに緑が本を閉じるようにしてピンクに近づきピンクがフィラメントの一部になる。
ムービーを見るにはQuickTime Playerのプラグインが必要です
![]() ダウンロードはこちら
ダウンロードはこちら

画像提供:村上健次、若林健之(帝京大学)
図5
リン酸が分子間小管(画面手前)にアクセスできるようになると共にATPが分解されるしくみ(動画)
ロイシンLeu110が下りることで、隣につながっているプロリンPro109も下りる。それによりヒスチジンHis161とのすき間に通り道ができる(裏口が開く)。ATPの加水分解で生じたリン酸Pはここを通って、画面手前の分子間小管に入る。(その後、一旦、リン酸結合部位に結合した後で、アクチンフィラメントの外へ出ていく。)
ムービーを見るにはQuickTime Playerのプラグインが必要です
![]() ダウンロードはこちら
ダウンロードはこちら
プロリンとヒスチジンが離れると、もう一つのスイッチが入ってATP分解がおき、3世代前のアクチンからリン酸が一つ放出されます。アクチンフィラメントのらせん構造の軸の辺りには、アクチン同士のすき間でできた分子間小管が存在し、ロイシンが下りることによりまるで裏口が開いたように通り道ができ、ATPの加水分解でできたリン酸が小管にアクセスできるようになります。小管を通って外の細胞液に出る前に、いったんリン酸はリン酸結合部位に結合して、しばらくの間フィラメントを安定な構造にすることが分かりました。
アクチンフィラメントは、4世代のアクチン分子による連携プレーで、まるでドミノ倒しのように次々と重合→ATP分解→リン酸の放出を繰り返していたのです。アクチンフィラメントが担う細胞の分裂や移動は、がんの浸潤、増殖、転移とも深くかかわるため、アクチン重合のしくみの解明は新薬開発にも一石を投じるものになります。この成果は2010年10月15日付けの米国科学誌Cellに掲載されました。
図6
若林健之教授と大学院生の五味渕由貴さん
石膏で作ったアクチンフィラメントの模型と実験ノートをそれぞれ手にしている。実験記録のまとめ方も、若林先生から代々引き継がれている。
背後に見えるのはアクチン・DNaseI・ゲルゾリンS1やトロポミオシン・トロポニンの一億倍分子模型。
「本当にラッキーでした」そう笑顔で語る若林先生。半世紀以上謎だった、アクチン重合とATP分解の両方に、マグネシウムが必須である理由の解明を振り返って語ります。「ATP分解はカルシウムでは起こらない反応、マグネシウムでしか起こらないんです。放射光では結晶にしないと見えない、結晶にするにはカルシウムの方が楽。だから今までATP分解のしくみが見えなかったんです。同じマグネシウムが、重合にも必須で、これまたカルシウムでは代用できないのです。」この研究は実に9年もの歳月がかかっています。全くのラッキーでないことは今までの経験と緻密なデータの積み重ねが物語っています。
今のようにコンピュータが普及していない時代に、数字の羅列から手作業で分子の形状を画像化し、手作りの模型を少しずつ動かしてアニメーションを作るなどして学会を驚かせてきた若林教授。そんな研究室には一見ジャングルジムかと思うほどの模型がたくさんあります。話す途中にも、次から次へと模型があちこちから出てきます。これらの模型が先生のインスピレーションを刺激したのでしょう。
![]() 毎週の記事のご案内をメールマガジン「news-at-kek」で配信します。
毎週の記事のご案内をメールマガジン「news-at-kek」で配信します。
詳しくは こちら をご覧ください。