
トピックス
イオンを利用して細胞の外にタンパク質を運ぶメカニズムを解明
2011年5月20日
東京大学の濡木理教授、塚崎智也助教、京都産業大学の伊藤維昭教授、京都大学の森博幸准教授らの研究グループは、細胞内で合成されたタンパク質が生体膜を超えて細胞の外に輸送されるメカニズムを、KEKフォトンファクトリーのNW12AおよびSPring-8のBL41XUを使って明らかにしました。
画像提供:東京大学濡木研究室
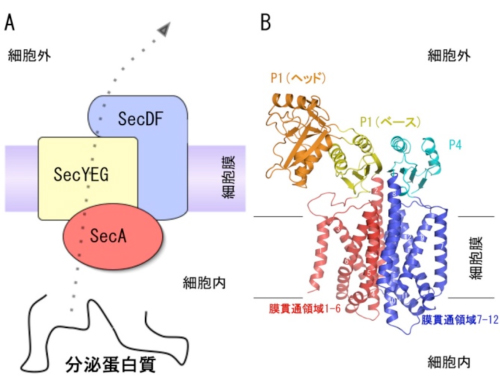
図1 蛋白質の膜透過とSecDFの詳細構造
- (A) Sec蛋白質複合体による蛋白質の膜透過の模式図
- (B) SecDFの結晶構造。数字で示した12回の膜貫通領域(1-6と7-12が疑似2回対象)と細胞外(ペリプラズム側)に突出した領域から構成されています。
全てのタンパク質は細胞内で合成され、その後、約30%は、実際に働く場所へと生体膜を超えて輸送されていきます。イオンさえも通れない生体膜を巨大な分子であるタンパク質が通り抜けることを可能にしているのは、生体膜にタンパク質を透過させるためのチャネルが存在することによります。この膜透過チャネルの駆動のしくみについては、多くの研究者が関心を抱き研究されています。濡木教授らは、真正細菌や古細菌でこのチャネルと複合体を形成しタンパク質の膜透過を高効率化していると言われるSecDFという膜タンパク質に着目しました。SecDFは水に溶けにくい膜タンパク質であり、精製や結晶化が困難でしたが、研究グループでは7年間の研究の末、大量精製および結晶化に成功しました。この結晶を放射光X線結晶構造解析することにより、立体構造を決定しました。
SecDFは12本のαヘリックスから成る膜貫通領域と、2つの細胞外領域から構成されることが分かりました。膜貫通領域は、既に構造が知られている薬剤排出に関わるタンパク質AcrBの膜貫通領域と構造が似ていることから、SecDFも水素イオン(プロトン)を利用することが考えられました。
タンパク質の膜透過反応はATPが必要な膜透過を開始するステップと、ATPがなくても進行する後期・完了というステップに分けられますが、SecDFは後期ステップに必要であることが分かりました。また、電気生理学的解析とSecDFの変異体解析によって、SecDFの膜貫通領域にはプロトンの通り道が存在することがわかりました。一方、2つの細胞外領域のひとつであるP1は、ダイナミックな構造変化を起こし、膜透過途中の分泌タンパク質などと結合する性質があることが分かり、この構造変化がタンパク質の膜透過反応に重要であることを示しました。
これらの結果から「生体膜を隔てた陽イオンの濃度差を利用してSecDFが大きな構造変化を繰り返し、膜を超えた蛋白質輸送に関与する」ということを実証しました。
この結果は英国科学誌Natureオンライン版に2011年5月12日付けで公開されました。