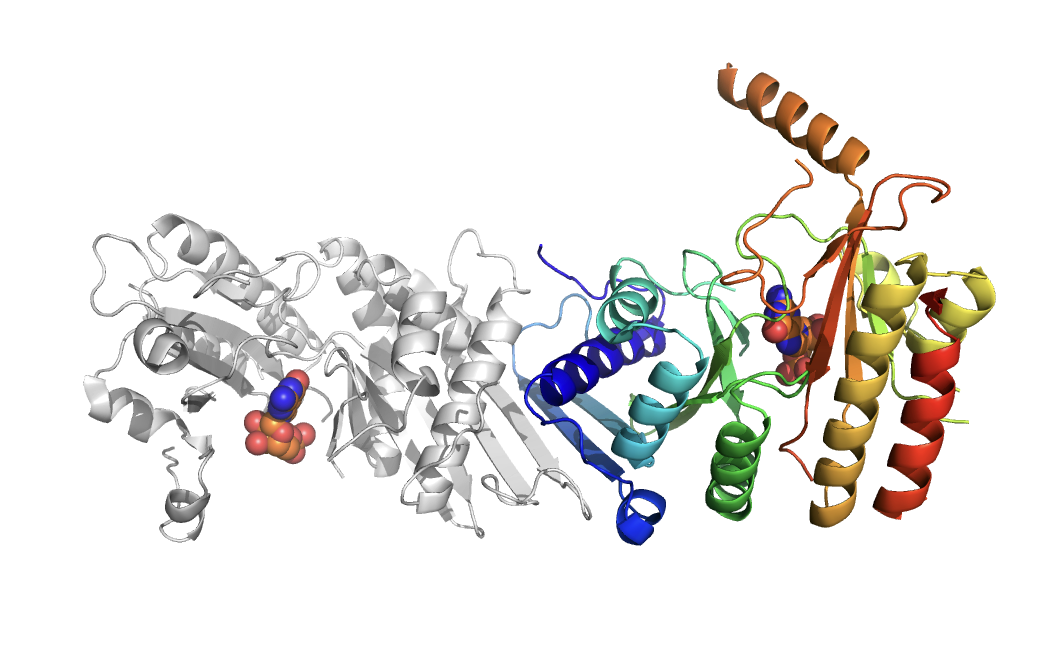
グアノシン三リン酸(GTP)は、DNAの構成要素であるだけでなく、タンパク質合成や細胞骨格系を駆動するエネルギー分子でもあります。興味深いことに、細胞内のGTPの量は組織によって大きく異なっています。特に、がん細胞ではGTP量が顕著に増加していることが知られています。これらのことから、細胞内のGTP量変化は生物学的に重要な役割を担っていると考えられます。そこで私たちは、GTPの代謝を研究することで、その生物学的意義を明らかにしようとしてきました。これまでに細胞内GTPセンサーであるPI5P4Kβを発見し、その進化を明らかにしています。さらに、GTP代謝システムは、がん、代謝性疾患、感染症、神経疾患、老化など、さまざまな病態に関連していると考えられるため、我々のGTP研究は新たな医薬品開発につながる可能性もあります。SBRCは、この共同研究の主要な担い手として、GTP代謝に関する構造生物学的な研究を行っています。
1. Takeuchi K*, Ikeda Y, Senda M, Harada A, Okuwaki K, Fukuzawa K, Nakagawa S, Yu HY, Nagase L, Imai M, Sasaki M, Lo YH, Ito D, Osaka N, Fujii Y, Sasaki AT*, Senda T*. (2022) The GTP responsiveness of PI5P4Kβ evolved from a
compromised trade-off between activity and specificity. Structure 30, 886-899.
2. Osaka, N., Hirota, Y., Ito, D., Ikeda, Y., Kamata, R., Fujii, Y., Chirasani, V. R., Campbell S. L., Takeuchi, K., Senda, T., Sasaki, A. T.* (2021) Divergent mechanisms activating RAS and small GTPases through
post-translational modification. Front. Mol. Biosci. 8, 707439.
3. Naffouje, R., Grover, P., Yu, H., Sendilnathan A., Wolfe, K., Majd, N., Smith, E. P., Takeuchi, K., Senda, T., Kofuji, S. and Sasaki, A. T.* (2019) Anti-Tumor Potential of IMP Dehydrogenase Inhibitors: A Century-Long Story.
Cancers 11, 1346.
4. Takeuchi, K., Senda, M., Lo, Y-H., Kofuji, S., Ikeda Y., Sasaki, A. T.* and Senda T.* (2016) Structural reverse genetics study of PI5P4β-nucleotide complexes reveals the presence of the GTP bioenergetics system in mammalian
cells.
FEBS J, 283, 3556-3562.
5. Sumita, K., Lo, Y.-H., Takeuchi, K., Senda, M., Kofuji, S., Ikeda, Y., Terakawa, J., Sasaki, M., Yoshino, H., Majd, N., Zheng, Y., Kahoud, E. R., Yokota, T., Emerling, B. M., Asara, J. M., Ishida, T., Locasale, J. W.,
Daikoku,
T.,
Anastasiou, D., Senda, T.* and Sasaki, A. T.* (2016) The lipid kinase PI5P4Kβ is an intracellular GTP sensor for metabolism and tumorigenesis. Mol Cell 61, 187-198.
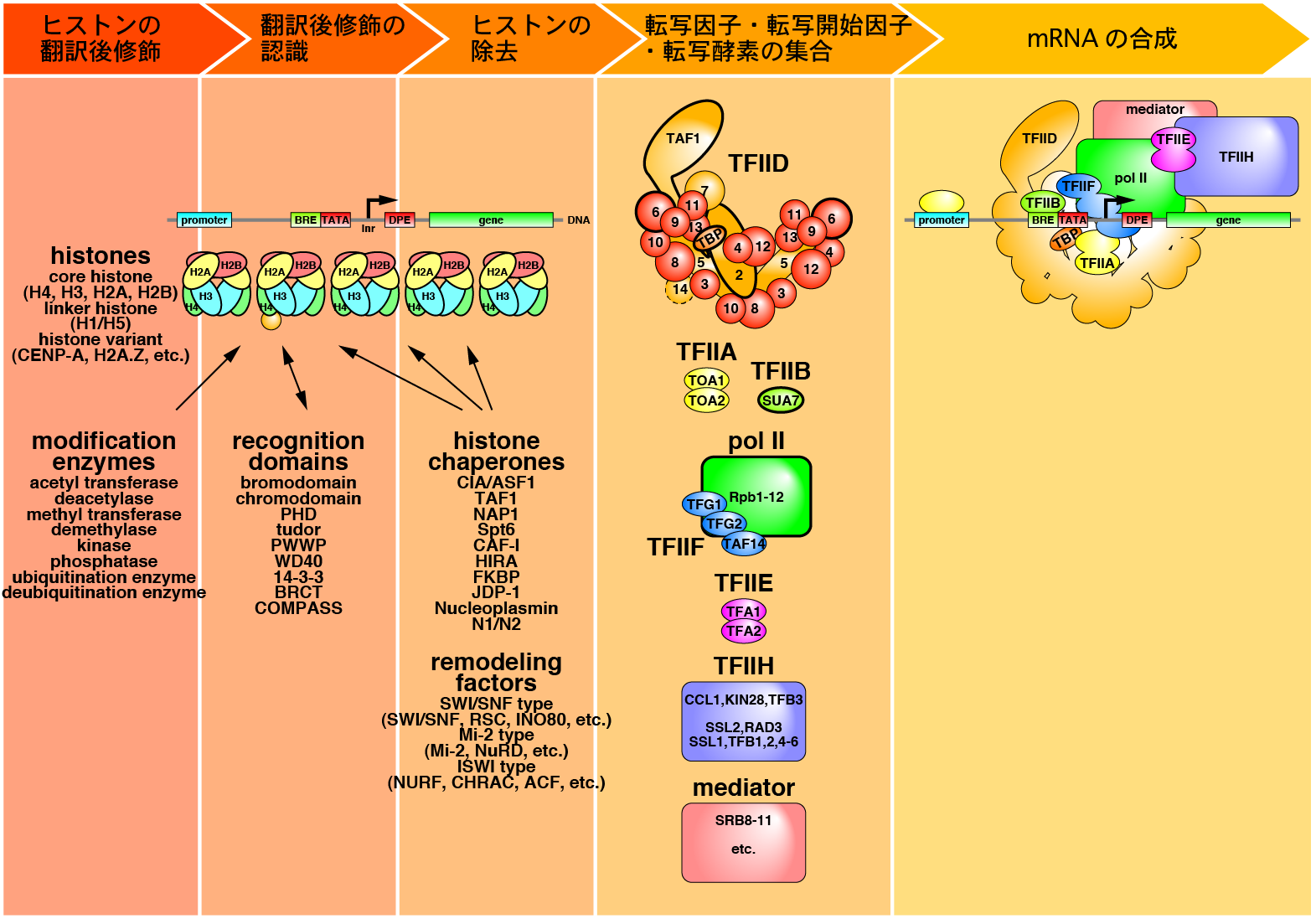
人間の遺伝情報量は、文字に換算するとわずか750MBに過ぎません。しかし、この量の遺伝情報によって、理性、感情、社会的・経済的・芸術的活動を行う能力を持った人間のような複雑な生物を作り出すことができるのです。生物は、環境からの刺激を受け、それを信号として処理し、活性化させる遺伝子のセットを選択しています。これは、高度に組織化された生物の情報処理システムと言えます。私たちは、生物が進化によって獲得した情報処理システムの仕組みを解明する事を目的とし、バクテリアからヒトに至るまで、遺伝子の働きを制御するタンパク質の立体構造の研究を行っています。
1. Giannopoulou, E. A., Senda, M., Koentjoro, M. P., Adachi, N., Ogawa, N., Senda, T.* (2021) Crystal structure of the full‐length LysR‐type transcription regulator CbnR in complex with promoter DNA. FEBS J. 288,
4560-4575.
2. Koentjoro, M. P., Adachi N., Senda, M., Ogawa, N. and Senda, T.* (2018) Crystal structure of the DNA-binding domain of the LysR-type transcriptional regulator CbnR in complex with a DNA fragment of the recognition binding
site in the promoter region. FEBS J. 285, 977-989.
3. Ray-Gallet, D., Ricketts, M. D., Sato, Y., Gupta K., Boyarchuk, E., Senda, T. Marmorstein, R. and Almouzni, G.* (2018) Functional activity of the H3.3 histone chaperone complex HIRA requires trimerization of the HIRA
subunit.
Nat. Commun. 9, 3103.
4. Akai, Y., Adachi, N., Hayashi, Y., Eitoku, M., Sano, N., Natsume, R., Kudo, N., Tanokura, M., Senda, T.*, Horikoshi, M.* (2010) Structure of the histone chaperone CIA/ASF1–double bromodomain complex linking histone
modification and site-specific histone eviction. Proc. Natl. Acad. Sci. USA. 107, 8153-8158.
5. Muto, S., Senda, M., Akai, Y., Sato, L., Suzuki, T., Nagai, R., Senda, T.* and Horikoshi, M.* (2007) Relationship between the structure of SET/TAF-Iβ/INHAT and its histone chaperone activity. Proc. Natl. Acad. Sci. USA.
104,
4285-4290.
5. Natsume, R., Eitoku, M., Akai, Y., Sano, N., Horikoshi, M.* and Senda, T.* (2007) Structure and function of the histone chaperone CIA/ASF1 complexed with histones H3 and H4. Nature 446, 338-341.

バクテリアは、工業的に重要な分子を含む多種多様な分子を生産・分解することができるため、有用な酵素の宝庫と考えられてきました。これらの細菌酵素は、酵素研究者の注目を集めるだけでなく、産業利用への応用も進んでいます。 私たちのグループでは、木材の主要成分であるリグニンの分解に関わる酵素など、バクテリアなどに由来する酵素の触媒反応機構を3次構造に基づいて研究しています。
1. Tao, H., Lauterbach, L., Bian, G., Chen, R., Hou, A., Mori, T., Cheng, S., Hu, B., Lu, L., Mu, X., Li, M., Adachi, N., Kawasaki, M., Moriya, T., Senda, T., Wang, X., Deng, Z., Abe, I.*, Dickschat, J. S.*, Liu, T.* (2022)
Discovery of non-squalene triterpenes, Nature, 606, 414-419.
2. Mori, T., Kumano, T., He, H., Watanabe, S., Senda, M., Moriya, T., Adachi, N., Hori, S., Terashita, Y., Kawasaki, M., Hashimoto, Y., Awakawa, T., Senda, T.*, Abe, I.* & Kobayashi, M.* (2021) C-Glycoside metabolism in the
gut
and in nature: Identification, characterization, structural analyses and distribution of C-C bond-cleaving enzymes. Nat. Commun. 12, 6294.
3. Kumano, T., Hori, S., Watanabe, S., Terashita, Y., Yu, H, Y., Hashimoto, Y., Senda, T., Senda, M.*, Kobayashi, M.* (2021) FAD-dependent C-glycoside-metabolizing enzymes in microorganisms: screening, characterization, and
crystal structure analysis. Proc. Natl. Acad. Sci USA, doi: 10.1073/pnas.2106580118
4. Katsuyama Y.*, Sone, K., Harada, A., Kawai, S., Urano, N., Adachi, N., Moriya, T., Kawasaki, M., Shin-ya, K., Senda, T.*, Ohnishi, Y. (2021) Structural and functional analyses of the tridomain-nonribosomal peptide
synthetase
FmoA3 for 4-methyloxazoline ring formation. Angewandte Chemie Int. 60, 14554-14562.
5. Nakashima, Y., Mori, T., Nakamura, H., Hoshino, S., Senda, M., Senda, T.* and Abe, I.* (2018) Structure, function and engineering of multifunctional non-heme iron dependent oxygenases in fungal meroterpenoid biosynthesis. Nat. Commun. 9, 104.
6. Harada, A., Kamimura, N., Takeuchi, K., Lo, Y.-H., Masai, E. and Senda, T.* (2017) The crystal structure of a new O-demethylase from Sphingobium sp. strain SYK-6. FEBS J. 284, 1855-1867.

ヘリコバクター・ピロリ菌は、胃の粘膜に生息する細菌です。ピロリ菌は世界人口の約半数に感染していると予想されており、胃がんをはじめとするさまざまな病気に関与しています。ピロリ菌が産生するがんタンパク質CagAは、胃粘膜細胞の様々なタンパク質と相互作用して細胞内シグナル伝達を撹乱し、がん等の疾病の原因になると考えられています。私たちは、CagAとその相互作用タンパク質の3次構造に基づき、CagAの機能発現機構を研究しています。
1. Hayashi, T., Senda, M., Suzuki, N., Nishikawa, H., Ben C., Tang, C., Nagase, L., Inoue, K., Senda, T.* and Hatakeyama, M.* (2017) Differential mechanism for SHP2 binding and activation are exploited by geographically
distinct
Helicobacter pylori CagA oncoproteins. Cell Rep 20, 2876-2890.
2. Hayashi, T., Senda, M., Morohashi, H., Higashi, H., Horio, M., Nagase, L., Sasaya, D., Shimizu, T, Venugopalan, N., Kumeta, H., Noda, N. N., Inagaki, F., Senda, T.* and Hatakeyama, M.* (2012) Tertiary structure and
functional
analysis of the Helicobacter pylori CagA oncoprotein. Cell Host Microbe 12, 20-33.
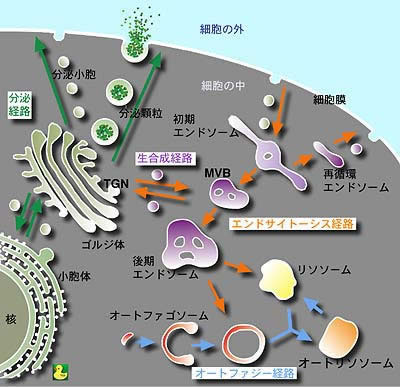
真核細胞には様々な細胞内小器官が存在するため、生命維持のためには、タンパク質や脂質などの細胞内物質が正確に輸送され、適切に分配されることが必要です。ですから、細胞内輸送系に関わるタンパク質の構造と機能の解明は、生命現象の解明に挑む研究者を魅了してきました。また、細胞内輸送系の異常は疾病の原因となるため、細胞内輸送系の制御機構を理解することは、そのような疾患の解明や治療につながると期待されています。私たちは、細胞内輸送の制御タンパク質であるGGAなどの立体構造を解析し、細胞内輸送の分子機構を解明しようとしています。(模式図は大阪大学吉森教授による)
1. Tanaka, H., Takahashi, T., Xie, Y., Minami, R., Yanagi, Y., Hayashishita, M., Suzuki, R., Yokota, N., Shimada, M., Mizushima, T., Kuwabara, N., Kato, R. & Kawahara, H. (2016) A conserved island of BAG6/Scythe is related to
ubiquitin domains and participates in short hydrophobicity recognition. FEBS J. 283, 662-677.
2. Kuwabara N., Minami R., Yokota N., Matsumoto H., Senda T., Kawahara H., Kato R. (2015) Structure of a BAG6 (Bcl-2-associated Athanogene 6)-Ubl4a (Ubiquitin-like Protein 4a) Complex Reveals a Novel Binding Interface That
Functions in Tail-anchored Protein Biogenesis. J. Biol. Chem. 290: 9387-9398.
3. Fujita H., Rahighi S., Akita M., Kato R., Sasaki Y., Wakatsuki S., Iwai K. (2014) Mechanism underlying IKK activation mediated by the linear ubiquitin chain assembly complex (LUBAC). Mol Cell Biol. 34, 1322-1335.
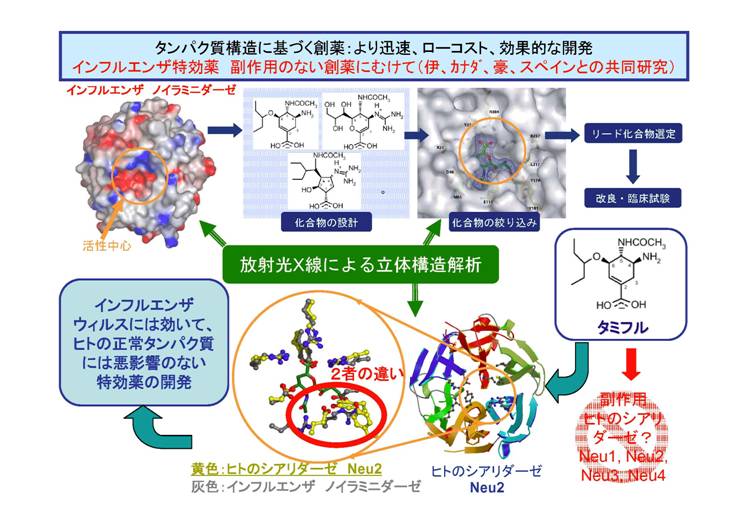
核酸、タンパク質に次ぐ第三の生体分子として、糖鎖(オリゴ糖)の重要性が高まっています。細胞表面の糖鎖は、血液型の決定因子としてよく知られていますが、糖鎖は細胞間のコミュニケーションにも重要な役割を担っており、癌の転移やウイルス感染にも直接的に関与していることが知られています。細胞内では、タンパク質のグリコシレーションは、細胞内輸送の重要な因子であるとともに、タンパク質の成熟度の指標としても働いています。さらに、多くの疾患は糖代謝の異常によって引き起こされることが知られているのです。このような糖鎖の重要性にもかかわらず、この分野には未解明な点が多く残されています。私たちは、糖鎖関連タンパク質の構造と機能の解明を目指しています。
1. R. Imae, N. Kuwabara, H. Manya, T. Tanaka, M. Tsuyuguchi, M. Mizuno, T. Endo, R. Kato (2021) The structure of POMGNT2 provides new insights into the mechanism to determine the functional O-mannosylation site on
α-dystroglycan. Genes to Cells 26,485-494.
2. N. Kuwabara, R. Imae, H. Manya, T. Tanaka, M. Mizuno, H. Tsumoto, M. Kanagawa, K. Kobayashi, T. Toda, T. Senda, T. Endo, R. Kato (2020) Crystal structures of fukutin-related protein (FKRP), a ribitol-phosphate transferase
related to muscular dystrophy. Nature Comm. 11, 303.
3. Makyio, H., Shimabukuro, J., Suzuki, T., Imamura, A., Ishida, H., Kiso, M., Ando, H., Kato, R (2016) Six independent fucose-binding sites in the crystal structure of Aspergillus oryzae lectin. Biochem. Biophys. Res. Commun.
477, 477-482.
4. Kuwabara, N., Manya, H., Yamada, T., Tateno, H., Kanagawa, M., Kobayashi, K., Akasaka-Manya, K., Hirose, Y., Mizuno, M., Ikeguchi, M., Toda, T., Hirabayashi, J., Senda, T., Endo, T., Kato, R. (2016) Proc. Natl. Acad. Sci.
USA
113, 9280–9285.
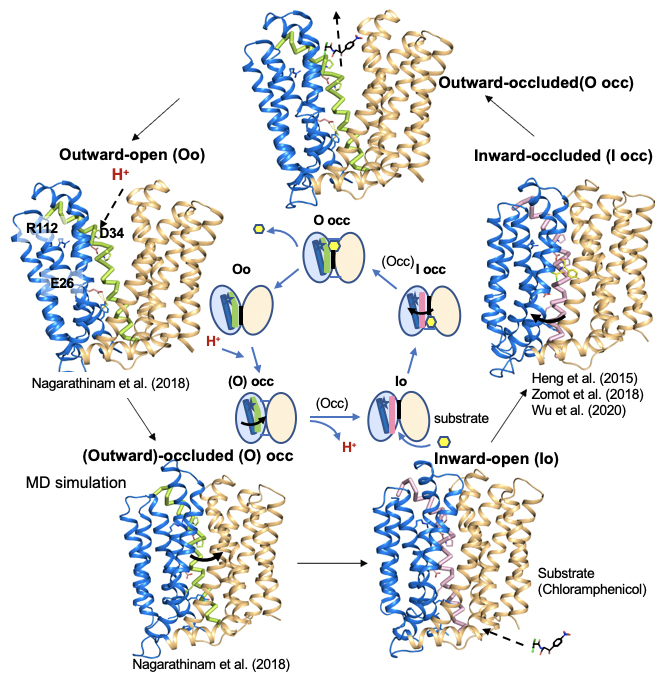
感染症は有史以来主要な死因の一つとなっています。ウィルス、日和見細菌による感染症、プリオンタンパク質など新たな病原体が次々と出現する一方で、よく知られている病原体も感染経路を変化させたり、病原性の因子や抗菌薬への耐性などを獲得し、問題を引き起こし続けています。私たちの先代は基礎研究と応用研究の組み合わせにより、天然痘の根絶など、素晴らしい成果を上げて来ました。我々もそれに続けと、特に細菌感染症に着目し、宿主と病原体の相互作用のメカニズムや病原細菌の薬剤耐性メカニズムを、構造生物学の集団的手法を用いて分子レベルで理解し、最終的に難治性の感染症問題に対する革新的な解決策を提示することを目指しています。
1. Drew, D.*, North, R., Nagarathiam, K.. Tanabe, M.* (2021) Structures and General transport Mechanisms by the Major Facilitator Superfamily (MFS). Chem. Rev. 121, 5289-5335.
2. Bartsch, A., Ives, CM., Kattner, C., Pein, F., Diehn, M., Tanabe, M., Munk, A., Zachariae, U., Steinem, C., Llabrés, S. (2021) An antibiotic-resistance conferring mutation in a neisserial porin: Structure, ion flux, and
ampicillin binding. Biochim Biophys Acta -Biomemb. 1863, 183601.
3. Bartsch, A., Llabrés, S., Pein, F., Kattner, C., Schön, M., Diehn, M., Tanabe, M., Munk, A., Zachariae, U., Steinem, C. (2019) High-resolution experimental and computational electrophysiology reveals weak β-lactam binding
events in the porin PorB Sci. Rep. 9, 1264.
4. Nagarathinam, K., Nakada-Nakura, Y., Parthier, C., Terada, T., Juge, N., Jaenecke, F., Liu, K., Hotta, Y., Miyaji, T., Omote, H., Iwata, S., Nomura, N., Stubbs, MT., Tanabe, M.* (2018) Outward open conformation of a Major
Facilitator Superfamily multidrug/H+ antiporter provides insights into switching mechanism. Nat. Commun. 9, 4005.