脳神経ネットワークを作る「信号」と「受容体」
#ハイライトヒトの脳には千数百億個もの神経細胞があり、それらが互いにつながってできた神経回路のネットワークができています。ヒトの体が作られる時、細胞は 外から さまざまな種類の「信号」を受け取り、それに応じて刻々と位置や挙動を変えていますが、これは神経細胞にもあてはまります。神経細胞はさまざまな「信号」 を受け取って、ネットワークを作っていき、複雑な脳神経ができあがるのです。
センサーにあたる「受容体」は神経細胞の表面にあり、外から来る「信号」を受け取るのですが、その情報がどのように細胞の中まで届いているのか、ほ とんど分かっていません。神経のネットワークを作るための信号経路は、免疫の働きや骨・血管を形成する際にも重要であることが分かり、そのしくみの解明が 待たれています。
神経のガイド役がもつ多彩な機能
大阪大学蛋白質研究所の高木淳一(たかぎ・じゅんいち)教授、禾晃和(のぎ・てるかず)助教(元KEK物構研ポスドク)らの研究グループは、信号と 受容体、特に脳神経のネットワークをつくる信号と受容体に興味を持ち、研究に取り組んできました。研究グループが注目した「セマフォリン」と「プレキシ ン」は、その信号と受容体のセットのひとつです。
脳神経のネットワークを作る時に、神経細胞同士を正しく繋げるには、軸索と呼ばれる"手"を近くに引き寄せる方法と、反発させて方向を変える方法が あります。セマフォリンは、神経細胞にあるプレキシンという受容体(センサー)と相互作用することで、軸索を反発させるシグナルを伝えると考えられていま す。
セマフォリンとプレキシンは、神経細胞の軸索が伸びていく際のガイド役として見つかったタンパク質ですが、最近では、体に異物が侵入した際に免疫細 胞を活性化する免疫応答にも関わっていることが分かっています。また新しい血管の形成や、骨の新陳代謝にも、このセマフォリンとプレキシンが引き起こす信 号経路が重要な役割を担っていることが明らかになっています。このため、セマフォリンとプレキシンの働きが異常をきたすと病気をひきおこすこともあり、ガ ンや自己免疫疾患、アトピー性皮膚炎などにもセマフォリンとプレキシンが関与していると考えられています。
シグナルが伝わる前と後
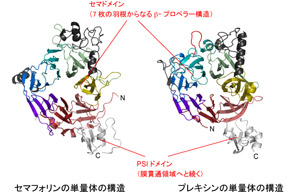
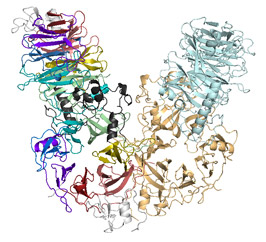
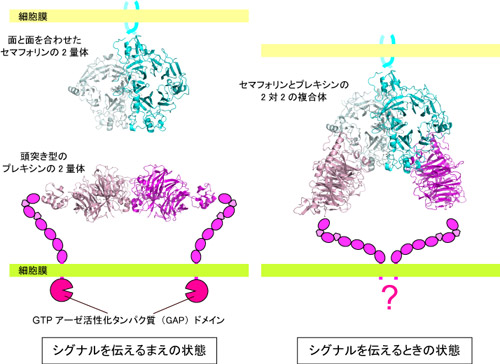
セマフォリンとプレキシンの立体構造は良く似ていて、扇風機のようなプロペラ構造をしています(図2a)。どちらも単独 ではいられず扇風機が二つくっついた形(二量体)で存在していますが、そのくっつき方がセマフォリンとプレキシンでは大きく異なっていました。セマフォリ ンでは、扇風機の面と面が向かい合ったような形をしており、プレキシンでは、扇風機が頭と頭を突き合わせたような形をしています(図2b, c)。これらの構造は、セマフォリンとプレキシンが出会う前、つまりシグナルを伝える前の状態を反映していると考えられます。
画像提供:大阪大学
図2 セマフォリン6Aとプレキシン2Aの構造
どちらも7枚の羽根からなる扇風機のようなプロペラ構造をもっている。
(b)セマフォリン6A二量体の構造(face-to-face型)
扇風機の面と面が向かい合うような形をしている。
(c)プレキシン2A二量体の構造(head-on型)
扇風機同士が頭突きするような形をしている。
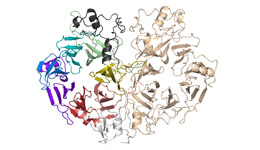
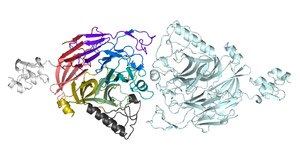
では、シグナルを伝えている時、セマフォリンとプレキシンはどのような状態になっているのでしょうか?それを調べるため、研究グループではセマフォ リンとプレキシンの複合体の結晶を作り、KEKフォトンファクトリーのBL-17Aなどを使って立体構造を調べました。その結果、セマフォリンとプレキシ ンは、2つずつ合わさった2対2の複合体構造をとっていることが分かりました(図3)。複合体では、セマフォリンはシグナルを伝える前と同じ、面と面が向 かい合った二量体のままでしたが、プレキシンは一つずつに分かれて、セマフォリンの二量体にくっついていました。
つまり、シグナルが伝わる際には、軸索の上でセンサーとして働いているプレキシンは二量体が2つに分かれて、信号であるセマフォリンと結合するので す。プレキシンは、セマフォリンと結合する前も、後も、2つ1組で働いていますが、2つのプレキシンの配置や向きは大きく変化しています。
細胞の中へ
このようにして細胞表面にあるプレキシンまで届いたシグナルが、細胞に変化を起こさせるには細胞の中へシグナルを届けなくてはなりません。プレキシ ンは細胞膜の上にいるタンパク質で、細胞膜を隔てた細胞の内側にはGTPアーゼ活性化タンパク質(GAP)ドメインへとつながっています。セマフォリンと の結合によってプレキシンの配置や向きが細胞外で大きく変わることにより、細胞膜を隔てて細胞内にあるGAPドメインの配置や向きも大きく変わり、活性化 の引き金となるのではないでしょうか(図4)。そして細胞内で様々なシグナル伝達が起こり、最終的に神経細胞の軸索が反発する(手を引っ込める)現象へと つながっているのではないかと研究グループは考えています。
画像提供:大阪大学
図4 セマフォリン結合によるGAPドメイン活性化の模式図
セマフォリンがくっつくことで、細胞外に露出しているプレキシンの形を大きく変え、それが細胞内のGAPドメインに伝わる様子は、「てこの原理」を 思い出させます。禾助教は「プレキシンがてことして働いているということを確かめ、細胞外での構造変化がGAPドメインの配置や向きをどのように変えるの かを知るためには、プレキシンを構成する他のドメインの構造を知る必要があり、今後はプレキシンの全体構造に迫るような構造解析に取り組んでいきたいと考 えています」とこの研究の続きを語っています。
この研究は文部科学省、ターゲットタンパク研究プログラムの下で行われ、英国の科学誌「Nature」の2010年10月28日号(オンライン版では9月29日付)に掲載されました。
-
カテゴリで探す
-
研究所・施設で探す
-
イベントを探す
-
過去のニュースルーム