抗マラリア薬の開発を目指して
#ハイライトマラリアという病気をご存知でしょうか?ハマダラ蚊によって媒介される感染症で、病原体はマラリア原虫という単細胞生物です。世界中で毎年3億〜5 億人が 感染し、100万〜300万人が死亡していると言われています。その大部分はサハラ以南のアフリカにおける5歳以下の子供で、少なく見積もっても30秒に 1人という恐るべきペースで子供達の命が奪われていることになります。さらに、既存の抗マラリア薬が効かないマラリア原虫が現れて問題になっています。
最近、マラリア原虫由来の酵素の立体構造がフォトンファクトリーで明らかになりました。この成果は、新しい抗マラリア薬の開発につながる可能性を秘めています。
人間にはない「非メバロン酸経路」を標的に
理想的な薬とは、なるべく人間には影響を与えずに、病原体(この場合はマラリア原虫)に大きなダメージを与えられることが重要な条件です。そのため に注目されているのが「非メバロン酸経路」と呼ばれる代謝経路です。この経路は、動物や植物の生存に必要なステロイドやビタミンAなどの「イソプレノイド 化合物」を生成する反応のひとつです。イソプレノイド化合物は、イソペンテニル二リン酸(isopentenyl diphosphate; IPP)の縮合によって生成されます。
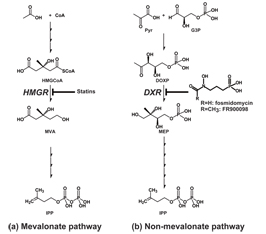
IPPという物質が注目されているのは、マラリア原虫では人間にはないIPP合成経路を持つということがわかったからです。人間では、IPPはアセ チル補酵素A(アセチルCoA)を出発物質としてメバロン酸(MVA)を経る「メバロン酸経路」によって生成されます(図1(a))。
画像提供:昭和大学薬学部 田中信忠
図1 生物におけるIPP生合成経路。
(a) メバロン酸経路。ヒトでは、IPPはアセチル補酵素A(アセチルCoA)を出発物質として3-ヒドロキシ3-メチルグルタリルCoA(HMG-CoA)からメバロン酸(MVA)を経る、「メバロン酸経路」によって生成される。
(b) 非メバロン酸経路。多くの細菌やある種の原生動物では、ピルビン酸とグリセルアルデヒド3リン酸を出発物質としてIPPを合成している。
以前はIPPの生合成は全てメバロン酸経路によるものと考えられていましたが、1993年、フランスのローマー(Rohmer)博士らによって、あ る種の細菌ではメバロン酸経路とは全く異なる代謝経路「非メバロン酸経路」によってIPPが生合成されることが証明されました(図1(b))。その後、ド イツのジョマア(Jomaa)博士らによって、熱帯熱マラリア原虫では、非メバロン酸経路によってIPPが合成されていることが発見されました。
ジョマア博士は、ホスミドマイシンという良く知られた抗生物質が、熱帯熱マラリア原虫の「非メバロン酸経路」の2番目の酵素1-deoxy-D-xylulose 5-phosphate reductoisomerase(DXR、マラリア原虫の学名 P. falciparum の頭文字を付けてPfDXRと表す)を阻害することでマラリア原虫の生育を抑制することを発見しました。そして、マラリア原虫に感染したマウスの治療にホ スミドマイシンの投与が有効であることを示し、この酵素PfDXRが新しい抗マラリア薬の理想的標的として注目されることになりました。
抗生物質がマラリア原虫の酵素に作用するしくみ
これまで、大腸菌など数種のDXRの立体構造は解析されてきましたが、PfDXRの立体構造解析には誰も成功していませんでした。昭和大学薬学部の 田中信忠(たなか・のぶただ)准教授、梅田知伸(うめだ・とものぶ)助教らのグループと、松山大学薬学部の中西雅之(なかにし・まさゆき)准教授、岐阜大 学工学部の北出幸夫(きたで・ゆきお)教授らとの共同研究チームは、ホスミドマイシンがPfDXRにどのように作用しているのか知ることがより有効な抗マ ラリア薬をデザインするための手がかりとなると考えました。
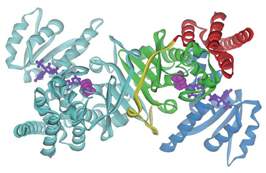
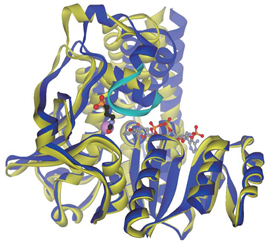
田中准教授らは、作用のしくみを見るため、(1) PfDXR(反応に必須の金属イオンおよび酸化還元補酵素NADPHを加えたもの)、(2) 阻害剤ホスミドマイシンと (1) の複合体、(3) ホスミドマイシンよりも強力な阻害剤であるFR900098と (1) の複合体、の3種類の結晶をつくり、KEKフォトンファクトリーの高性能タンパク質構造解析ビームラインAR-NW12Aで立体構造を解析しました。見え たPfDXRは2量体を形成しており(図2)、阻害剤であるホスミドマイシンとFR900098は、この酵素の活性部位にある溝のような部分に結合してい ました。阻害剤がない場合と結合している場合の構造を比較してみると、図3のように構造が大きく変化していることがわかり、阻害剤が無い場合では安定した 構造をとっていないループ(水色)部分が阻害剤の結合により安定化されていることが分りました。
画像提供:昭和大学薬学部 田中信忠
図2 PfDXRの2量体構造
補酵素NADPHをball-and-stickモデル、阻害剤ホスミドマイシンを空間充填モデルで表示。他の生物種由来DXRと同様に2量体を形成していた。
画像提供:昭和大学薬学部 田中信忠
図3 PfDXRに対する阻害剤の結合による構造変化
補酵素NADPHおよび阻害剤ホスミドマイシンをball-and-stickモデルで表示。阻害剤の結合によりサブユニットの構造がopen型(黄)からclosed型(青)へと変化している。
新しい抗マラリア薬開発の手がかり
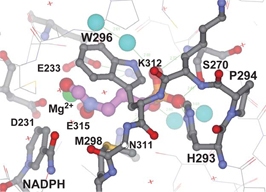
図3を見ると、水色のループ部分(図3)は、ピンクの球で示した阻害剤ホスミドマイシンの近くにあることが見てとれます。ホスミドマイシン結合部位 を詳しく見てみると(図4)、ホスミドマイシンは、酵素PfDXRの活性部位の金属イオン(緑)や水分子(水色)を含んだ水素結合ネットワークで PfDXRに結合しており、ループ領域はそれにふたをするような形で、ヒスチジン(H293)、トリプトファン(W296)、メチオニン(M298)など のいくつかのアミノ酸残基がホスミドマイシンと結合を作っていました。
また、今回の研究では、ホスミドマイシンより強力な阻害剤であるFR900098との複合体の構造も明らかになりました(図5)。 FR900098(紫)では、ホスミドマイシンにはないメチル基(矢印)が存在します。このメチル基は、トリプトファン側鎖(W296)が回転することに よって酵素PfDXRの活性部位にうまく収容されていることが分りました。
ホスミドマイシンにはまだまだ改良の余地が残されているようです。活性部位にちょうどぴったりはまり込むような阻害剤は、酵素とより強く結合し、よ り強力な薬剤となることが期待できます。例えば、水分子が結合している空間を埋めるような阻害剤を設計したり、ループの柔軟性を利用してもう少し大きな官 能基を阻害剤に導入するなど、構造がわかったことによって新しい薬剤のアイディアがいくつも考えられるようになりました。
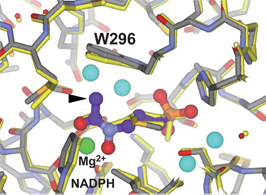
画像提供:昭和大学薬学部 田中信忠
図5 ホスミドマイシンとPfDXR 、FR900098とPfDXRの複合体の構造比較
FR900098結合部位。FR900098の炭素原子を紫で表示。FR900098特有のメチル基を矢印でラベル。Trp296側鎖の回転により、FR900098特有のメチル基(矢印)を収容している。活性部位に結合した4分子の水は、両複合体で保存されていた。
ホスミドマイシンは、クリンダマイシンという抗生物質との併用による抗マラリア薬として、タイおよびガボンで臨床試験が既に進行しています。この成果によって、より効果的な抗マラリア薬の開発がすすみ、30秒に1人の命が奪われる悲劇が無くなる日がきっと来るでしょう。
この研究は、最も権威のある学術雑誌のひとつであるネイチャー(Nature)誌の新しい系列誌「Scientific Reports」の創刊号(6月14日)に掲載されました。
-
カテゴリで探す
-
研究所・施設で探す
-
イベントを探す
-
過去のニュースルーム