水中のタンパク質分子のねじれ運動を動画として観測することに成功
- タンパク質の分子機能解析を生体に極めて近い環境で実現する新技術 -
#プレスリリース
平成24年4月10日
大学共同利用機関法人 高エネルギー加速器研究機構
国立大学法人 東京工業大学
独立行政法人 科学技術振興機構
韓国科学技術院
|
・生体内の環境に極めて近い室温の水溶液中で、タンパク質分子のねじれ運動を動画として直接観測 |
【概 要】
韓国科学技術院(KAIST)のHyotcherl Ihee(イ ヒョッチョル)教授らの研究グループは、高エネルギー加速器研究機構(KEK)物質構造科学研究所の足立伸一(あだち しんいち)教授、東京工業大学大学院理工学研究科の腰原伸也(こしはら しんや)教授、および米国シカゴ大学の研究グループとの共同研究により、X線を用いて、水中のタンパク質分子のねじれ運動を100億分の1秒の時間精度で動画観測することに初めて成功した。
血液中で酸素分子を運搬するタンパク質であるヘモグロビン分子に短時間のレーザー光を照射し、照射後に進行するタンパク質の分子構造変化を、時間分解X線溶液散乱法※1によって追跡した。この手法は、生体環境に極めて近い室温の水溶液中で、様々なタンパク質が実際に働く自然な姿を動画として捉えることを可能とする画期的な手法であり、生命活動にとって重要なタンパク質の分子機能を解析するための新技術として大いに期待される。
本研究成果は、米国化学学会誌「Journal of the American Chemical Society」のオンライン速報版で近日中に公開される。
【背 景】
タンパク質は、アミノ酸が1本の鎖となって折り畳まれた構造を取り、その折り畳まれた構造が、酵素活性などの生体内の生命活動にとって重要な機能に深く関わっている。特に、折り畳まれたタンパク質が、ある特定の動き(構造変化)をすることで、栄養素を分解したり、筋肉を動かしたりといった様々な機能を果たしている。しかし、実際のタンパク質が、高速に動きながら機能している姿を動画的に、しかも水中で室温といった生体内の環境と極めて近い状態で観測することは困難であった。
【研究内容と成果】
本研究の対象となったタンパク質は、二枚貝がもつヘモグロビンで、血液中で酸素運搬の機能を担っている。二枚貝のヘモグロビンは人間の血液中にあるヘモグロビンとは少し異なり、二つのユニットが弱く結合した形をしている(図1)。二つのユニットにはそれぞれ、鉄-ポルフィリン錯体(ヘム)※2が収まっており、その鉄に酸素や一酸化炭素などのガス分子が可逆的に結合し運搬される。
ヘモグロビンの二つのユニットに結合したガス分子がタンパク質から解離すると、二つのユニットの位置関係が相対的に変化し、ガス分子が結合しやすい構造(R型)から結合しにくい構造(T型)へと変化すると考えられていた。そこで本研究グループは、KEKの放射光科学研究施設のビームラインNW14Aを用いて、時間分解X線溶液散乱法を用いた動画撮影に挑戦した。この実験では、ヘモグロビンを含む溶液にレーザー光とX線をほぼ同じタイミングで繰り返し照射してX線散乱データを測定することにより、最終的にタンパク質の構造変化の情報を取り出すことができる。
本研究では、常温で試料にレーザー光を照射し、ヘモグロビン分子内のヘムと一酸化炭素の結合を切断して、瞬間的に一酸化炭素がタンパク質から解離した状態を作り出した。そして、この過渡的な状態から始まるタンパク質の構造変化を、時間分解X線溶液散乱法を用いて、レーザー光とX線の時間を系統的にずらしながら逐次観測した(図2)。すると、ヘモグロビン分子が100億分の1秒(100ピコ秒)から100分の1秒(10ミリ秒)程度の時間内に徐々に構造変化し、二つのユニット間の距離が短くなるとともに、二つのユニットが相対的に約3度回転している様子が明らかとなった。いわば溶液の中のヘモグロビン分子が、あたかも「濡れタオルを絞るような」ねじれ運動で形を変化させ、鉄に結合したガス分子を絞り出してゆく様子が、100億分の1秒精度のX線動画として直接観測されたのである(図3)。
【本研究の意義、今後の展望】
本研究で用いた時間分解X線構造解析法により、タンパク質の静止した構造だけでなく、その機能に深く関連して時々刻々と構造が変化する様子を、二枚貝のヘモグロビンを一例として直接的に動画化できることが証明された。
この技術は、他の多くの機能性タンパク質分子にも原理的に適用可能なものであり、機能解析のための分子動画作成技術の可能性が膨らみつつある。「タンパク質構造全体が協同的に変化して、その機能を発揮する」という生体物質の本質に対して、そのベールを解き放つ鍵としての新技術がまさに我々の手元に届きつつある。この技術がさらに発展すれば、新薬を設計する上で重要な指針・情報を与えることが期待される。
本成果は、JSTさきがけ研究領域「光エネルギーと物質変換」研究課題名:「時間分解X線構造解析法による光エネルギー変換機構の分子動画観測」 研究者: 足立伸一(高エネルギー加速器研究機構物質構造科学研究所教授)、JST 戦略的創造研究推進事業(CREST) 研究領域「先端光源を駆使した光科学・光技術の融合展開」研究課題名:「光技術が先導する臨界的非平衡物質科学」研究代表者:腰原伸也(東京工業大学大学院理工学研究科教授)によって得られたものである。
【お問い合わせ】
<研究内容に関すること>
大学共同利用機関法人 高エネルギー加速器研究機構 物質構造科学研究所 教授
足立 伸一(あだち しんいち)
TEL: 029-879-6022
FAX: 029-864-3202
E-mail: shinichi.adachi@kek.jp
<JSTの事業に関すること>
独立行政法人 科学技術振興機構 戦略研究推進部
原口 亮治(はらぐち りょうじ)、木村 文治(きむら ふみはる)
TEL: 03-3512-3525
FAX: 03-3222-2063
E-mail: presto@jst.go.jp
<報道担当>
大学共同利用機関法人 高エネルギー加速器研究機構 広報室長
森田 洋平(もりた ようへい)
TEL: 029-879-6047
FAX: 029-879-6049
E-mail: press@kek.jp
国立大学法人 東京工業大学 評価・広報課 広報・社会連携グループ
坂本 和慶(さかもと かずよし)
TEL: 03-5734-2975
FAX: 03-5734-3661
E-mail: hyo.koh.sya@jim.titech.ac.jp
独立行政法人 科学技術振興機構 広報課
上野 茂幸(うえの しげゆき)
TEL: 03-5214-8404
FAX: 03-5214-8432
E-mail: jstkoho@jst.go.jp
 図1 二枚貝のヘモグロビンの模式図。上下に二つのユニットが重なっており、二つのユニットの相対的な位置関係の変化により、酸素が結合しやすい構造(R型)と結合しにくい構造(T型)の間を行き来する。それぞれのユニット内の中央付近に収まっている平面状の分子が、鉄-ポルフィリン錯体(※2)である。
図1 二枚貝のヘモグロビンの模式図。上下に二つのユニットが重なっており、二つのユニットの相対的な位置関係の変化により、酸素が結合しやすい構造(R型)と結合しにくい構造(T型)の間を行き来する。それぞれのユニット内の中央付近に収まっている平面状の分子が、鉄-ポルフィリン錯体(※2)である。
[静止画] [動画]
 図2 水中のヘモグロビン分子が過渡的に構造変化することによるX線溶液散乱曲線の時間変化
図2 水中のヘモグロビン分子が過渡的に構造変化することによるX線溶液散乱曲線の時間変化
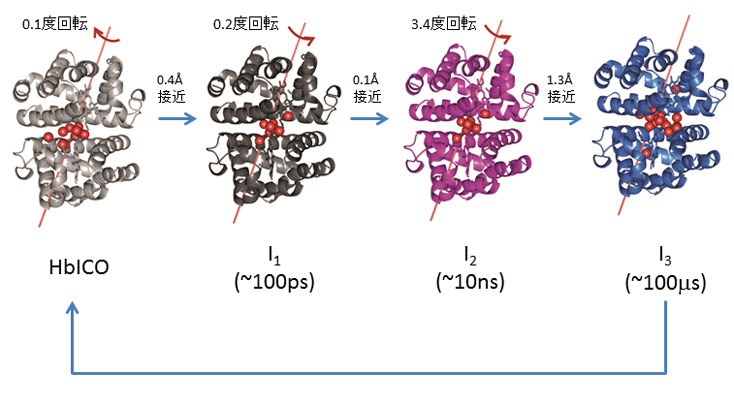 図3 ヘモグロビン分子の構造変化の模式図。二つのユニット間の位置関係が徐々に変化し、ユニット間の距離が1.3Åだけ短くなるとともに、二つのユニットが相対的に3.4度回転している。いわば溶液の中のヘモグロビン分子が、あたかも「濡れタオルを絞るような」ねじれ運動で形を変化させ、鉄に結合したガス分子を絞り出してゆく様子が捉えられている。
図3 ヘモグロビン分子の構造変化の模式図。二つのユニット間の位置関係が徐々に変化し、ユニット間の距離が1.3Åだけ短くなるとともに、二つのユニットが相対的に3.4度回転している。いわば溶液の中のヘモグロビン分子が、あたかも「濡れタオルを絞るような」ねじれ運動で形を変化させ、鉄に結合したガス分子を絞り出してゆく様子が捉えられている。
【用語解説】
※1:時間分解X線溶液散乱法
溶液試料に短い時間幅のレーザー光を照射すると、短時間で溶液中のタンパク質分子が光のエネルギーを吸収して、過渡的な状態に変化する。この瞬間のX線溶液散乱データを短パルスX線により収集する測定手法である。
※2:鉄-ポルフィリン錯体(ヘム)
鉄イオンとポルフィリンと呼ばれる環状構造分子から成る物質で、酸素分子が鉄イオンと結合して、酸素の貯蔵と放出をする機能を持つ。本研究ではヘムを含んでいるヘモグロビンを研究対象とした。
関連サイト
放射光科学研究施設フォトンファクトリー
腰原・沖本研究室
さきがけ
関連記事
2012.3.1 プレスリリース
光合成機能をもつ有機分子が働く瞬間を直接観察
20111.1.17 プレスリリース
レーザー光によって100億分の1秒間だけ現れる新しい物質構造をパルスX線で世界で初めて検出
2009.12.15 プレスリリース
光が一瞬の磁石を作り出す
2009.2.10 プレスリリース
たんぱく質分子内を小分子が移動する様子の動画撮影に成功
2007.12.13 プレスリリース
原子配列が壊れる瞬間をストロボ撮影
-
カテゴリで探す
-
研究所・施設で探す
-
イベントを探す
-
過去のニュースルーム