細胞の代謝とがん化を司る、細胞内エネルギーセンサーを発見
#プレスリリース平成28年1月8日
大学共同利用機関法人 高エネルギー加速器研究機構
国立研究開発法人 産業技術総合研究所
|
● 細胞内のエネルギー物質"GTP"の濃度を検知する"GTPセンサー"を世界で初めて発見 |
【概要】
高エネルギー加速器研究機構(KEK)物質構造学研究所、シンシナティー大学医学部、産業技術総合研究所(産総研)創薬分子プロファイリング研究センターによる合同研究チームは、細胞内のエネルギー物質"GTP"の濃度を検知し、細胞の働きを制御する"GTPセンサー"を世界で初めて発見しました。
タンパク質合成やシグナル伝達の原動力となるGTPの濃度を正しく保つことは、細胞機能の維持に不可欠です。同チームは、脂質キナーゼ※1の一種PI5P4Kβが細胞内のGTPセンサーであることを発見、PI5P4KβとGTPとの複合体の立体構造解析などによってそれを証明しました。決定した立体構造に基づきGTPセンサー機能を持たないPI5P4Kβを人工的に作成し、細胞内に戻したところ、細胞がGTP濃度の変化に正しく応答できなくなりました。さらに同チームは、PI5P4KβのGTPセンサー機能が、がんの増殖にも関与することを明らかにしました。本研究成果により今後、がんおよび代謝疾患への治療や創薬が大きく展開していくことが期待されます。
本研究の成果は、米国の科学雑誌「Molecular Cell」にFeatured Article(注目記事)として平成28年1月7日(現地時間)に掲載されます。
本研究は創薬等支援技術基盤プラットフォーム事業、科学研究費 22121005(研究代表者 : 千田俊哉)、25121743(研究代表者:竹内恒)などの支援を受けて実施されました。
【論文情報】
雑誌名:Molecular Cell
論文名:"The lipid kinase PI5P4Kβ is an intracellular GTP sensor for metabolism and tumorigenesis", doi: 10.1016/j.molcel.2015.12.011.
(和訳:脂質キナーゼPI5P4Kβは代謝とがん化を司る細胞内GTPセンサーである)
著者:Kazutaka Sumita, Yu-Hua Lo, Koh Takeuchi, Miki Senda, Satoshi Kofuji, Yoshiki Ikeda, Jumpei Terakawa, Mika Sasaki, Hirofumi Yoshino, Nazanin Majd, Yuxiang Zheng, Emily Rose Kahoud, Takehiro Yokota, Brooke M. Emerling, John M. Asara, Tetsuo Ishida, Jason W. Locasale, Takiko Daikoku, Dimitrios Anastasio, Toshiya Senda and Atsuo T. Sasaki
1.背景
全ての生き物は、生きるためにエネルギーを必要とします。そのため私達の体を構成する一つ一つの細胞には、エネルギー変化に応じて、適切な応答を起こす仕組みが備わっています。例えば、"生体のエネルギー通貨"として広く知られるATPの細胞内の濃度変化は、複数の"ATPセンサー"タンパク質により感知されて、細胞の代謝や遺伝子発現を変化させます。
一方、細胞で主にタンパク質の合成やシグナル伝達の原動力となるエネルギー物質として働くのが"GTP"です。GTPの細胞内濃度はATPとは独立に制御されており、細胞内のGTP濃度を検知し、細胞機能を制御する"GTPセンサー"は未だ発見されていませんでした。また、そのため細胞がどのようにしてGTP濃度を検知し、その濃度変化に応じて適切な細胞応答を引き起こすのかは、これまで不明なままでした。
2.研究内容と成果
本研究では、GTPセンサーの正体をつきとめるべく、GTPに結合するタンパク質を細胞内から広く探索しました(図1)。その結果、脂質二次メッセンジャー※2の一つである、PIPを介して細胞のシグナル伝達を制御する脂質キナーゼの一種、PI5P4Kβタンパク質がGTPに強く結合することを見出しました。PI5P4Kβは、これまでがんや糖尿病との関連が示されていましたが、その機能の詳細は明らかではありませんでした。また、ヒトの細胞内には脂質キナーゼを含め、約500種類のキナーゼが存在しますが、これらと同様に、PI5P4KβはATPを、基質であるPI(5)Pのリン酸化に用いると考えられていました。しかし、本研究において、PI5P4KβがGTPを用いる非常に珍しいキナーゼであり、生理学的なGTP濃度変化に伴って、PIPのリン酸化活性を大きく変化させることが示されました(図2)。この証明には、PI5P4KβとGTPとの複合体の立体構造解析が大きな鍵となりました。KEKのフォトンファクトリーを用いた、PI5P4KβとGTPとの複合体の立体構造解析により、PI5P4KβがどのようにGTPと特異的に結合するのかを明らかにしました(図3)。さらに、決定した立体構造に基づきGTPセンサー機能を持たないPI5P4Kβを人工的に作成し、細胞内に入れたところ、その細胞はGTP濃度の変化に対し、適切に応答できなくなることを確認しました。これらの研究により、PI5P4Kβが細胞内のGTP濃度を検知し、脂質シグナルを介して、細胞応答を制御する"GTPセンサー"であることが明らかとなりました(図4)。
さらに研究チームは、GTPセンサー機能をもつ本来のPI5P4Kβを発現するがん細胞は、増殖し腫瘍を形成するのに対して、GTPセンサー機能を持たないPI5P4Kβを発現するがん細胞は増殖せず、腫瘍を形成しないことを明らかにしました(図5)。このことは、PI5P4KβのGTPセンサー機能が、がんの増殖に必要であることを示しています。これまでの研究から、がん細胞や代謝疾患では、GTP濃度が非常に高くなるなど、GTPを含む細胞のエネルギーの制御が破綻していることが知られています。この発見は、本来GTPセンサーとして細胞内エネルギーの制御を担うべきPI5P4Kβが、がんでは、病気の悪化に関与していることを示しています。本研究の成果は、がんおよび代謝疾患において細胞のエネルギー制御が破綻する仕組みを理解する助けになるとともに、これらの病気に対する治療や創薬へと、大きく展開していくことが期待されます。
3.今後の期待と展望
今回の発見で、細胞がGTP濃度を感知し、応答する仕組みが初めて明らかとなりました(図4)。また本来、正しい細胞の応答を担う仕組みが、がんでは、むしろ病気の悪化に関与していることが明らかとなりました。細胞内GTPエネルギーの制御機構については、その濃度を検知するGTPセンサーが不明であったこともあり、これまでほとんど研究されてきませんでした。今回の発見を契機にして、多くの研究者が参画し、生命のエネルギー利用の仕組みや病気について、より深い理解が進んでいくことが期待されます。さらにGTPエネルギー研究分野の発展に伴い、関連するがんや代謝疾患などの新たな治療法が見いだされ、より豊かな社会の実現につながることも期待されます。
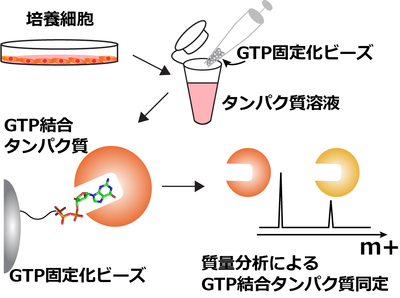 図1 PI5P4KβのGTP結合能の発見
図1 PI5P4KβのGTP結合能の発見
GTP固定化ビーズを用い、GTPと結合するタンパク質を細胞内から探索した結果、PI5P4Kβが見つかりました。
 図2 PI5P4KβのGTP利用能の発見
図2 PI5P4KβのGTP利用能の発見
生理学的なGTP濃度域(0.1~0.5 mM)とATP濃度域(1.0~5.0 mM)におけるPI5P4Kβ活性変化量の違い。GTP濃度変化によるPI5P4Kβ活性の変化量が大きく、PI5P4KβがGTPセンサーとして機能していることが示されました。
 図3 立体構造解析によるGTP結合様式の解明
図3 立体構造解析によるGTP結合様式の解明
PI5P4Kβの結晶に、測定中にPI5P4Kβによって分解されないGTP類似体およびATP類似体を加え、複合体の立体構造を得ました。立体構造の解析により、GTPを認識する部位を特定するとともに、ATP結合との比較により、PI5P4KβがGTPを特異的に認識する仕組みが分かりました。
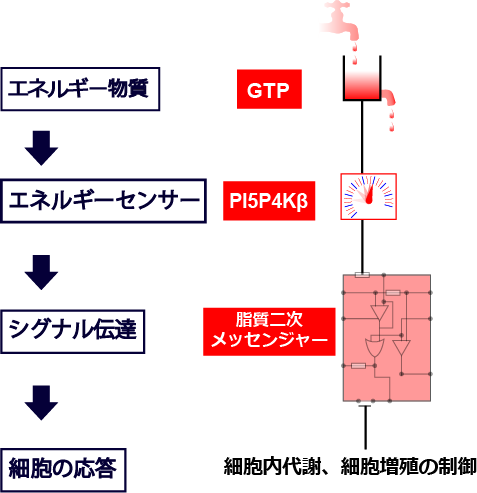 図4 細胞内GTPセンサーとしてのPI5P4Kβの役割
図4 細胞内GTPセンサーとしてのPI5P4Kβの役割
PI5P4Kβは細胞内のGTP濃度を検知し、脂質二次メッセンジャーPI(5)Pを介して、細胞内代謝やがんを含む細胞の増殖を制御する"GTPセンサー"であることが明らかとなりました。
 図5 がん細胞の増殖へのPI5P4Kβの寄与の発見
図5 がん細胞の増殖へのPI5P4Kβの寄与の発見
通常のPI5P4Kβおよび、GTPセンサー機能を持たないGTP非感受性のPI5P4Kβをがん細胞に発現させました。その結果、通常のPI5P4Kβではがん細胞が増殖、腫瘍を形成したのに対し(上、赤矢印)、GTP非感受性PI5P4Kβではがん細胞が増殖しないことが確かめられました(下)。
【用語解説】
※1 脂質キナーゼ
細胞膜などに存在するイノシトールリン脂質をリン酸化し、シグナル伝達を行う一群のタンパク質(酵素)。例えば今回、細胞内GTPセンサーであることが明らかとなったPI5P4Kβの場合、5位がリン酸化されたイノシトールリン脂質-5-リン酸(PIP)をリン酸化し、4位および5位がリン酸化されたイノシトールリン脂質-4,5-二リン酸(PI(4,5)P2)を生成する。
※2 脂質二次メッセンジャー
細胞膜などに存在し、情報伝達を担い、その細胞内濃度が細胞の代謝などに影響を及ぼす脂質分子のこと。
【問い合わせ先】
(研究内容に関すること)
大学共同利用機関法人 高エネルギー加速器研究機構 物質構造科学研究所
教授 千田 俊哉(せんだ としや)
E-mail: toshiya.senda@kek.jp
国立研究開発法人 産業技術総合研究所 創薬分子プロファイリング研究センター
主任研究員 竹内 恒(たけうち こう)
E-mail: koh-takeuchi@aist.go.jp
(報道担当)
大学共同利用機関法人 高エネルギー加速器研究機構
広報室長 岡田 小枝子(おかだ さえこ)
E-mail: press@kek.jp
国立研究開発法人 産業技術総合研究所 企画本部報道室
E-mail: press-ml@aist.go.jp
-
カテゴリで探す
-
研究所・施設で探す
-
イベントを探す
-
過去のニュースルーム