水素発見から250年
#ハイライト
図1 ヘンリー・キャベンディッシュ(1731-1810)
英国の化学者・物理学者。
1766年、英国のヘンリー・キャベンディッシュが人類で初めて水素を取り出すことに成功した。金属片と強酸を反応させ、「燃える気体(※水素という名は1783年に命名)」を単離、その気体は空気よりもずっと軽く、激しく燃えるという性質を調べた。2016年、今年は水素の発見から250年になる。
全ての源
水素は陽子一個と電子一個から構成される、最も単純な原子。「スイ、ヘー、リー、ベ...」と、口ずさみながら覚えた人も多いであろう、元素周期表で一番の元素である。最も単純な元素である水素は、宇宙で最初に作られた元素でもあり、現在も宇宙を構成する元素の90%を占める。そして宇宙空間に広がった水素を主成分とするガスなどは、星間雲、さらに高密度に集まり恒星にもなる。地球から最も近くにある太陽もまた、ほとんどが水素で構成されている(原子数比85%)。太陽では水素からヘリウムが作られる核融合反応が起きている。その時放出されるエネルギーの一部は、光や熱として地球へ届き、光合成により二酸化炭素と水と共に有機物へと変化する。作られた有機物は、現在でも地球上の全ての動物が外部から得られる唯一のエネルギー源となっている。こうした活動が何億年と続き、変貌した姿が化石燃料となり、それをエネルギー源として利用し、我々は生活を豊かにしてきた。
また陽子一個、電子一個というシンプルな構造は、電子の授受を容易にする。通常「水素イオン」と言えば電子を一つ放出した陽イオンH+であるが、逆に電子を1つ受け取った陰イオンH-は「水素化物イオン」「ヒドリドイオン」と呼ばれ、
機能性材料の設計において最近注目されている。また他の原子と電子を共有して分子を作りやすく、変幻自在な存在でもある。
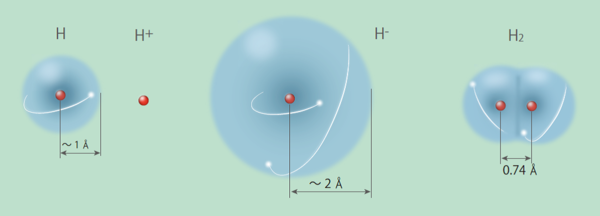
図2 水素原子、分子の種類
水素原子(H):陽子一個、電子一個 ※ボーア半径は、0.053 nm。実際の電子は広がっているため、大きさの決め方はいろいろある。
水素イオン(H+):陽子一個
水素化物イオン、またはヒドリド(H-):陽子一個、電子二個
水素分子(H2)
水素と生命
生命の中にも多くの水素がある。多くは水(H2O)として存在しているが、タンパク質や脂質の材料として、生命活動を担うイオンとして、至る所に水素が使われている。例えば、生命の設計図と言われるDNAでは、アデニン(A)とチミン(T)、グアニン(G)とシトシン(C)というペアの塩基同士が、水素を介在した結合をしている(水素結合)。水素結合は共有結合に比べて弱い結合で、特定の相手と決まった方向にしか結合を作らない。したがって、塩基は必ず特定の相手同士と結合するし、方向がずれると結合が弱くなり簡単にほどける。この、水素結合の絶妙な"ゆるさ"が生命を支えている。また生命活動では水素イオン(H+)の存在も欠かせない。細胞の中は様々な細胞小器官が生体膜で仕切られており、膜を隔てたH+濃度勾配を利用している反応がいくつか存在する。代表的なものがATP(アデノシン三リン酸)合成酵素。ATPは生体内でのエネルギーの受け渡しをする「エネルギーの通貨」とも言われる物質で、細菌からヒトまで普遍的に使われている。H+濃度の膜の外側からH+濃度の低い膜の内側へ、H+の流れによりATP合成酵素が回転し、ADPからATPが合成される。そのため、膜の内外にH+濃度差を作りだす仕組み「プロトンポンプ」が備わっている(図3)。

図3 生体中の水素
DNAの塩基同士は水素結合で繋がれている。C-Gは水素結合が3つ、A-Tでは2つ、と水素結合の違いによって結合する相手を選択もしている。
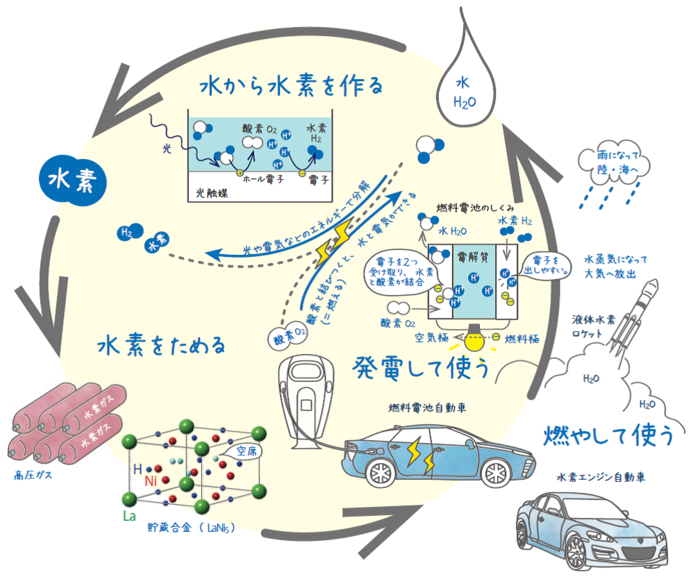
水素をつくる・使う
燃料電池自動車やエネファームなど、徐々に水素社会が現実のものとして広がりを見せつつある。しかし水素社会実現には、まだいくつかの課題が残されているのも事実である。水素利用は大きく3つのステップ「作る・貯める・使う」に分けられる(図4)。その中で一番ネックとなっているのが水素製造。水から水素を取り出し、電気として利用して、再び水に戻すサイクルが確立すれば、CO2排出、エネルギー格差などの問題解消につながる。しかし現在使われている水素の多くはメタンなど化石燃料から水素を取り出したものであり、光触媒など水から水素を安定的に製造する技術の実用化が待たれる。
もう一つの課題は、水素を安全に貯蔵する技術。水素は常温常圧では気体(H2分子)のために、ガソリンなどと比べると、かさばる燃料である。自動車でいうと、一般的に必要とされる航続距離500 kmを達成するには5 kg、常温常圧で6万リットルの水素が必要になり、自動車に搭載するには1000倍程度まで圧縮する必要がある。現在の燃料電池車は、700 気圧の高圧水素ガスタンクを用いている。しかし、水素ガスの圧縮係数が1よりも大きいため、圧力をさらに上げてタンク内の水素を増やすことは効率的ではない。また、液化水素は、低温に維持するためのエネルギーが必要である。そこで高密度に水素を貯蔵する技術として、金属内に水素を吸蔵・放出する貯蔵合金が開発されている。ランタンやジルコニウムなどある種の金属に対しては、水素は水素分子H2として存在しているよりも、水素原子Hに分かれて金属の中に入ったほうがエネルギー的に安定という性質を持っている(図5)。それを利用して水素の出し入れをコントロールするのが貯蔵合金である。しかし、一般に金属であるために自動車に搭載するには重量が増えてしまうのが難点であり、「貯める」技術に関しては、ガスタンク、貯蔵合金、軽量な非金属貯蔵材料などの開発が求められている。

図5 水素吸蔵による金属格子の変化
吸蔵前(左)はきれいに格子が揃っているが、水素が入り込むと(右)格子が歪み、体積は120%程度にまで膨張する。水素の出入りによって構造が破壊されるものもあるが、出入りをコントロールできる材料は水素貯蔵材料に適しているといえる。
水素社会到来とともに発生する、新たな課題も見えてきている。水素社会とは換言すると水素と様々な材料が接する機会が多くなるということである。水素はあらゆる元素の中で一番小さいがゆえに、どこにでも入り込みやすい。例えばガスボンベのシール材として使われているポリマーでは、分子の隙間に入り込み、高圧力の状態から常圧に戻った時、入り込んでいた水素が膨張し、結果シール材を破断させてしまうおそれがある。また、ボンベなどに使用される金属にさえも水素は入り込む。入った水素が、金属中を移動し、局所的に高濃度に集まることで金属を脆くし、場合によっては破断させてしまう事もある(水素脆性)。物質中に入り込んだ水素が、どこでどんな振る舞いをしているのか、実際には良くわかっていない。それは水素があまりにも小さくて単純な構造だからである。電子の広がりも含めた水素の姿を捉えるには、放射光や中性子、ミュオンといった量子ビームを駆使しても難しい。観測する技術の開発も必要なのだ。
小さな水素に大きな可能性
物性としての面白さも見逃せない。
水素は超伝導の立役者でもある。一つは電子を放出し易く、どこにでも入りやすいという特性から、H-を電子の供給源として超伝導体に注入していくことで超伝導転移温度を上げていくという研究。もう一つは水素自身が超伝導になるというもの。理論的に予測されていたものの、木星中心部程度の超高圧(3,600 GPaと見積もられている)でしか実現せず、人類が手にするのは難しいと考えられていた。ところが2014年にドイツの研究チームが硫化水素を超高圧力にすると約200 K(約-70℃)で超伝導状態になることを発表した。これまで不可能に近いほど困難だと考えられていた室温超伝導が今世紀中には手に届くのではないかと、物性研究者らが湧きたっている。今後の展開に注目したい。
水素をキーワードに周囲を眺めると、宇宙、生物、エネルギー、物性、と広範な分野に渡ることが良くわかる。水素発見から250年、そして水素社会へシフトしようとしている今、改めて水素について考えてみてはいかがだろうか。
関連記事
2015.5.27
水素で世界を変えられるか
2015.3.24 物構研トピックス
クロムに水素を7つ結合、新しい水素貯蔵材料へ
2013.5.23 ハイライト
燃料電池自動車のカギ、水素貯蔵のしくみ
2012.5.7 プレスリリース
岩塩(NaCl)構造をもつレアアースメタルの水素化物を発見
-
カテゴリで探す
-
研究所・施設で探す
-
イベントを探す
-
過去のニュースルーム