細胞の代謝とがん化を司るGTPセンサー
#ハイライトがん。長年日本人の死因トップに位置し、今やがんになる確率は日本人の2人に1人とも言われている。がんに侵され、みるみる細くなっていく人の姿を目にしたことのある人もいるだろう。その理由は様々だが、正常な生命活動に必要なタンパク質の生産より、がん細胞の増殖にエネルギーが使われてしまうためと考えられている。
エネルギー源GTP
GTP(グアノシン3リン酸)はタンパク質の合成やシグナル伝達に関わるエネルギー分子で、細胞内エネルギー代謝に不可欠な存在である。がん細胞ではエネルギー源としてGTPが多量に消費されている。これを裏付ける現象が、がん細胞の爆発的な増殖と、その一方で痩せていく生体そのものの変化。こうした現象をGTPというフィルターを通して捉える研究が行われている。
90年におよぶ細胞のエネルギー研究において、GTPの重要性は見過ごされてきた。そのなかで米国シンシナティ大学癌研究所の佐々木敦朗(あつお)准教授は、GTPの代謝に興味を持ち、がん細胞のGTP濃度変化を調べた。細胞分裂などでGTPが使われればGTPは減るはずだが、がん細胞はむしろGTPを増やしており、状況に応じて濃度を巧みに変化させていた。このことから佐々木氏は、細胞にはGTP濃度の変化を感知してGTP量を制御するしくみあり、がんはこれを利用して増殖するのではないかという仮説を立てた。これを証明するために「GTPセンサー」タンパク質を探し始めた。ただし、細胞内のタンパク質は2~3万種類、この中から存在するかどうかも分からないGTPセンサーを探し出そうというのだ。計画は無謀と言われ、常識を超えるアイデアに研究費を得ることも困難だった。それでも勝算があると考えた佐々木氏は研究を進めた。GTPセンサーはGTPに結合するはず。工夫を重ね、細胞からGTPと結合するタンパク質を見つける方法を確立した。可能性を絞り、最終的に脂質キナーゼの一種PI5P4Kβに注目した。しかし、当時PI5P4Kβは、GTPに似た細胞内のエネルギー分子であるATP(アデノシン3リン酸)に結合し酵素反応に使うと考えられていた。キナーゼは、ATPを反応に使うものと信じられていたのである。
 図1 GTP固定化ビーズを用い、GTPと結合するタンパク質を細胞内から探索、PI5P4Kβを発見。
図1 GTP固定化ビーズを用い、GTPと結合するタンパク質を細胞内から探索、PI5P4Kβを発見。
人と人との出会い
同じ頃、米国ハーバード大学に在籍していた竹内恒氏(現在は産業技術総合研究所、主任研究員)と研究会で知り合い、共同研究が始まった。NMRを利用したタンパク質の構造解析が専門の竹内氏は、PI5P4KβがATPよりGTPに強く結合して酵素反応に利用することをNMRを使って明らかにした。一方佐々木氏は、PI5P4KβはATPとも結合するが、脂質キナーゼとしての働きはATPの細胞内濃度域では変化せず、GTPの濃度変化だけに伴って変化することを見つけた。細胞内でのPI5P4Kβの活性がGTPの濃度変化で変わる性質は、GTPセンサーの条件に合致すると思われた。しかし、これを証明するには、ATPに対する働きは変えずにGTPに対する働きだけを失ったPI5P4Kβを作り、生体内での働きを比較する必要がある。そして、このような変異型PI5P4Kβのデザインには、PI5P4KβがどのようにGTPとATPとを見分けるのかを原子レベルで知る必要があり、NMRでは難しかった。その後、帰国し産総研へと異動した竹内氏は、千田俊哉氏、美紀氏(現在はKEK物構研教授、特任助教)と出会った。千田氏は放射光を利用したタンパク質結晶構造解析のプロ。結晶さえあればX線で構造を見ることは可能として、結晶構造解析を担うことになった。
竹内氏はPI5P4Kβの結晶を作り、千田氏に託す日々が始まった。千田氏はフォトンファクトリーで実験がある度に調べるが、なかなかデータが取れない。結晶から立体構造を決めるには、X線の回折像がいるのだが、どの結晶も回折点が現れない。その結果を受け取り、竹内氏は再び結晶を作り、また託す。結晶を渡し始めてから約半年が経っていた。

左から:千田俊哉 教授、竹内恒(こう) 主任研究員、千田美紀 特任助教。 実験を行ったフォトンファクトリーBL-17Aにて。
衝撃的な転機

図2 改質前のPI5P4Kβの結晶(左)とX線回折像(右)。
「このままではダメだ。一度実験しているところを見においでよ。」千田(俊)氏に呼ばれ、竹内氏は初めてフォトンファクトリーを訪れた。実験現場を見て納得。その第一印象は強烈なものだった。「結晶に毛が生えている!!」
X線結晶構造解析では、X線照射による損傷を軽減するため、窒素の冷気(約−180℃)で冷やしながら測定する。竹内氏が目にした「毛」というのは、冷気によって結晶にできた霜だった(図2)。結晶というと鉱物のような硬いイメージを持つが、タンパク質の結晶は殆んどが水。例えるならば豆腐のようなもの。非常に脆く、水をたくさん含むため、結晶内で大量に作られた氷が結晶を破壊していたのだ。もちろん回折像が出るわけもない。
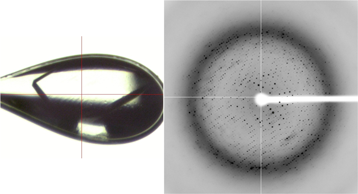
図3 改質後のPI5P4Kβの結晶(左)とX線回折像(右)、
結晶がきれいに透き通り、回折点が広範囲に出現した。一方、色々な結晶を長年見てきていた千田(美)氏は「結晶化しているのだから、絶対に回折像が見えるようになる。」と確信に近い思いを抱いていた。その頃、千田(美)氏は結晶改質の技術開発に取り組み、いくつか成功していたのだ。竹内氏の作った結晶は、触っただけで崩れてしまうものも多く、このままではいくら時間をかけても十分な回折像を見ることは出来ないと考えていた。同時に改質方法のアイディアも持っていた。それは、結晶冷却時に用いる約20種類の試薬候補の中からPI5P4Kβ結晶に適したものをいくつか選び出し、複数の試薬を組み合わせて使う方法である。考えた通り、1つめの試薬に結晶を浸けた後で2つめの試薬を加える2段階処理を行うと、ダメージを与えることなく結晶を冷やすことがきた。見事に生まれ変わった結晶からは十分な回折像が得られ、分解能は最高で2.1Åに達した(図3)。そしてGTP類似体やATP類似体が結合した状態の立体構造を決定、PI5P4KβがATPとGTPとを見分ける仕組みも原子のレベルで明らかになった。この構造を参考に、竹内氏は、GTPと結合する働きだけがなくなった変異型PI5P4Kβを作り上げた。
PI5P4KβはGTPセンサーに相応しい性質を持つが、生体内でPI5P4KβがGTPセンサーとして働いていることが示されなければ生物学として意味がない。竹内氏は作った変異型PI5P4Kβをシンシナティの佐々木氏に送った。シンシナティでは、野生型、変異型のPI5P4Kβを持つがん細胞をマウスに移植する生物学実験が行われた。研究グループの仮説が正しければ、変異型のがん細胞は増殖しないはずである。実験結果は劇的だった。正常なPI5P4Kβを与えたマウスではがん細胞が増殖し、腫瘍が形成されたのに対し、GTPセンサー部分を働かなくさせた変異型PI5P4Kβではがん細胞が増殖しなかった(図4)。ついにPI5P4KβがGTPを感知し、細胞増殖など細胞応答のシグナル伝達に関わる分子であることが示されたのである。

図4 野生型PI5P4Kβおよび、GTPセンサー機能の無いPI5P4Kβのがん細胞における比較。野生型PI5P4Kβではがん細胞が増殖、腫瘍を形成し(左、赤矢印)、GTPセンサー機能の無いPI5P4Kβではがん細胞が増殖しなかった(右)。
関連記事
2016.1.8 プレスリリース
細胞の代謝とがん化を司る、細胞内エネルギーセンサーを発見
関連サイト
シンシナティ大学癌研究所 佐々木研究室
構造生物学研究センター
産業技術総合研究所 創薬分子プロファイリング研究センター
-
カテゴリで探す
-
研究所・施設で探す
-
イベントを探す
-
過去のニュースルーム

