筋ジストロフィー発症のしくみ
#ハイライト #物構研
筋ジストロフィーとは、全身の筋力が徐々に衰えていく、遺伝性筋疾患の総称。 日本では一万人に1~2人が発症している一方で、病態には不明な部分が多く、根本的な治療法が未だに存在しない厚生労働省の指定難病である。
東京都健康長寿医療センターの遠藤玉夫副所長は、老化に伴う筋力低下の原因として、筋細胞が接着する仕組みを調べていた。 そして、筋細胞を接着、安定させるタンパク質ジストログリカンに注目した。 ジストログリカンは筋細胞表面の細胞膜にある糖タンパク質で、糖鎖、ラミニンを介して基底膜と筋細胞を結合させる役割を持つ(図1)。 筋肉の様にダイナミックに動く細胞では、糖鎖を介して結合することで、筋肉の伸縮による細胞と基底膜とのずれ動きに対応している。 これが上手く働いていないと、筋肉の伸縮時に細胞膜が破れることで細胞が破壊され、結果、筋細胞の減少、筋力の低下につながる。
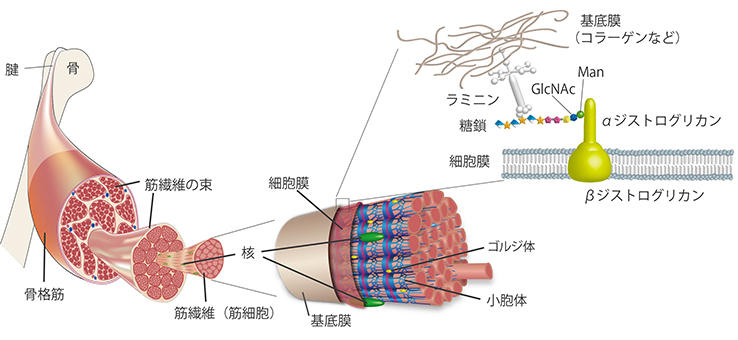
この現象が筋ジストロフィーでも起きていた。ジストログリカンから伸びる糖鎖の解明に乗り出した遠藤副所長は、Man(マンノース)、GlcNAc(N-アセチルグルコサミン)という糖から成る糖鎖を発見、2001年には2番目の糖鎖であるGlcNAcを付ける酵素POMGnT1というタンパク質を発見した。
POMGnT1がジストログリカンの糖鎖を作る過程を具体的に解明するための共同研究が始まった。 構造生物学を専門としているKEK物質構造科学研究所の加藤龍一准教授、タンパク質の糖修飾を専門としている桑原直之研究員らは、POMGnT1の立体構造から、糖鎖が作られる場所と仕組みを原子レベルで解明しようとした。

「最初はとにかくタンパク質の発現に苦労しました」と振り返る加藤准教授。 立体構造を得るには、まず目的のタンパク質を大量に得ることが必要なのだ。 最も簡易で良く使われているのは大腸菌だが、複雑なタンパク質は作ることができない。 ヒトと同じ真核細胞である酵母や昆虫培養細胞なども試し、哺乳類細胞でPOMGnT1の発現に成功、ようやく結晶を得ることができた。 およそ10年の歳月が過ぎていた。 結晶をフォトンファクトリーの結晶構造解析ビームラインを用いて得られた立体構造が図2になる。

構造は大きく触媒領域(青)とステム領域(緑)の二つの部位に分かれており、予測されていた活性部位は触媒領域にある。 だが立体構造をつぶさに調べるも、糖鎖を付けるターゲットのタンパク質を強く認識するような結合は存在しなかった。 「正直、どうしようかと思いました。これじゃあ論文にならないな、と」桑原研究員。 「テーマを変えることまで考えましたよ。糖鎖が出来る経路から考えると、このタンパク質(POMGnT1)をやって意味あるのかなあ、って(笑)」。
糖鎖が作られる経路
体内では、タンパク質に糖が結合することで、機能発現や、細胞での局在などが制御される。 ジストログリカンの場合、まず小胞体内でManが結合される。 その後ゴルジ体に運ばれてPOMGnT1によって、GlcNAcが結合される(図3左側の経路)。
桑原研究員が見ようとしていたのはまさにこの部分だった。 ところが、ジストログリカンのユニークな糖鎖の発見後、世界中で精力的に研究された結果、ラミニンと結合する糖鎖はPOMGnT1を経由しない別の経路で出来ることが見いだされていた(図3右側の経路)。 しかし生体現象としてはPOMGnT1に異常があるとラミニンと結合する糖鎖は出来ず、筋ジストロフィーを発症する。
関係あるのか無いのか、構造から判断しようと試みたものの、確たる情報が得られず、心が折れそうになるところだった。 転機となったのは構造生物学研究センター長である千田俊哉教授の一言。 「こっちのステム領域も調べてみたら?」一見関係無さそうな部位(図2緑)を調べるよう助言した。 ステム領域と呼ばれる機能未知な部分を調べると、糖鎖を認識できそうな構造をしていた。産業技術総合研究所の平林淳主席研究員らと共に、生化学実験から調べるとPOMGnT1がMan-GlcNAcの糖鎖、そしてMan-GlcNAc-GalNAc(N-アセチルガラクトサミン)の糖鎖の両方を認識することが分かった。
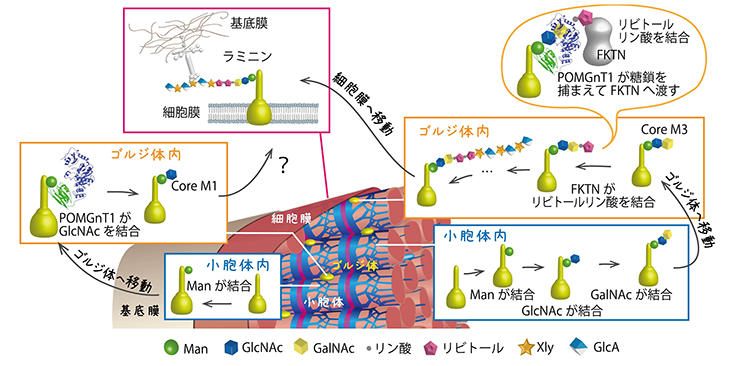
POMGnT1がFKTNを手助け
残る課題は疾患との関係。 細胞膜でラミニンと結合する糖鎖ができるには、POMGnT1の様に糖を結合させる酵素がたくさん関与する。 その中の一つ、FKTN(フクチン)は福山型筋ジストロフィーの原因となっているもので、Man-GlcNAc-GalNAにリビトールリン酸という糖を結合させる(図3右側の経路)。 この糖鎖はさらに伸びて、ラミニンと直接結合する糖鎖になる。ここまでの結果が示すように、POMGnT1がcore M1に加えてcore M3も認識できるとしたら、ゴルジ体内でPOMGnT1と隣接して働いているFKTNへの橋渡しをしている可能性が高い(図3右上)。 これは、POMGnT1とFKTNが複合体を形成するという以前の観察*1とも一致する。
そこで遠藤副所長は神戸大学の戸田達史教授らと共同で、POMGnT1の機能を働かなくした細胞を作り、筋ジストロフィーモデル細胞で検証実験を行った。 そしてPOMGnT1のステム領域の糖結合性がFKTNの機能、およびラミニン結合に必要な糖鎖形成に必須であることを確かめた。 X線結晶構造解析から得られた立体構造を始めとして、原子レベルから細胞レベルまでの階層横断的な研究が結実し、POMGnT1の機能、そして筋ジストロフィー疾患への影響を解明できた*2。
遠藤副所長は、この一連の研究を顧みて次のように語った。 「最初にジストログリカンのユニークな糖鎖を見つけてから、何度も浮き沈みがありました。ジストログリカンに付く最初の二つの糖鎖を解明したのは我々ですが、筋細胞接着に関わる糖鎖は他のチームに発見されてしまいました。今回のPOMGnT1の場合も、分割して触媒領域だけで結晶化するという進め方もあったと思います。でも、もしそうしていたらステム領域の働きは分からなかったでしょうし、FKTNとの連携作用までたどり着かなかったでしょう。加藤さんらが本当に苦労して結晶化してくれたお陰で、糖鎖に関わる最後のピースをきちんと我々の手で埋めることが出来ました」。 また、筋ジストロフィーの治療に向けても「福山型筋ジストロフィーというのは、日本人に多く発症する筋ジストロフィーで、日本人(福山幸夫博士)によって発見されました。 だからこそ、日本人の手で解明し、治療法を開発しなければいけない病気だと思っています」と語った。
参考文献
- (*1) Biochem. Biophys. Res. Commun., 350, 935-941, 2006. (doi: 10.1016/j.bbrc.2006.09.129)
- (*2) PNAS 113, no.33(2016)9280-9285 (doi: 10.1073/pnas.1525545113)
関連記事
-
カテゴリで探す
-
研究所・施設で探す
-
イベントを探す
-
過去のニュースルーム