これは科学者のみならず、多くの人が関心を抱く謎でしょう。現在、最も生命の起源に近いと考えられている生物が超好熱菌です。字のごとく、通常の生物ではとても生息できない高温の場所を好み、他の細菌や真核生物には無い性質を持っている菌です。その中の一種、スルホロバス(Sulfolobus)から、これまでの生化学の常識を覆す発見が放射光によって明らかにされました。
温泉や海底熱水噴出孔の周りにいる微生物で、80~90℃以上でも生息できるものを総称して超好熱菌と呼びます。通常、このような環境で生物は生きていられません。生物の身体を構成し、生命活動を担うタンパク質は高温下では変質してしまうからです。このような過酷な環境下で増殖する超好熱菌は、通常の生物には無い特殊なタンパク質があるに違いありません。そして驚くことに私たちヒトも植物もカビも、先祖をたどっていくとこの超好熱菌にたどり着くのです(図1赤線)。全ての生物に共通の祖先がこの超好熱菌であることから、生命が誕生したころの地球はとても高温であったと推測されています。
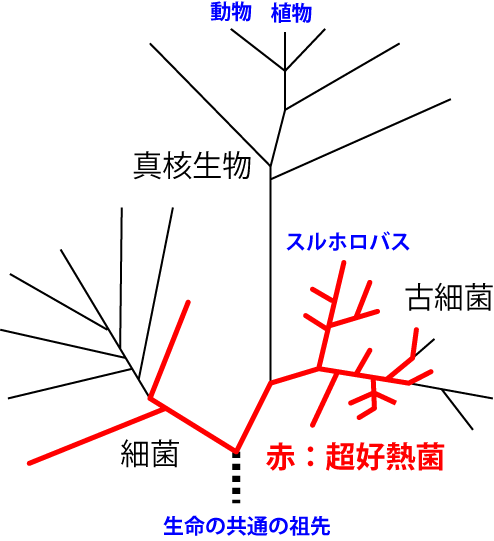 図1:生物の進化系統樹の概略
図1:生物の進化系統樹の概略生物が生きていくためのエネルギーは、糖を分解することによって得られます。超好熱菌の中には、炭酸ガス(二酸化炭素CO2など)のように単純な構造の無機物から複雑な構造をしている糖(グルコースC6H12O6など)を合成するものがあります。エネルギーの源である糖を糖以外のものから合成する反応は原始的な生命が進化する上で、重要と考えられています。
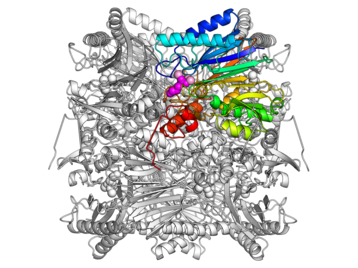 図2:FBPアルドラーゼ/ホスファターゼの全体構造
図2:FBPアルドラーゼ/ホスファターゼの全体構造東京大学大学院の若木高善(わかぎ たかよし)教授と伏信進矢(ふしのぶ しんや)准教授らの研究グループは、大分県の別府温泉から採取した超好熱菌スルホロバスを使ってこの反応過程を長年にわたって研究してきました。以前には同じスルホロバスの、グルコースをリン酸化する酵素ヘキソキナーゼを発見するなど、糖を分解したり合成したりする経路の解明に挑んできました。
糖を合成するにはいくつかの段階があり、炭酸ガスから、リンゴ酸、ビルビン酸、そしてフルクトースを経て糖(グルコース)になります。他のすべての生命活動と同様に、糖の合成も酵素と呼ばれるタンパク質が化学反応を進める触媒の働きをしています。酵素は、よく鍵と鍵穴に例えられるように、反応に使われる物質がぴったりはまるような形をしています。そのため、1つの酵素は1つの反応専用であり、多段階の反応では反応の数だけ別の酵素が働きます。
ところが昨年、超好熱菌では、糖の合成経路の中の2つの反応を1つの酵素が担っていることが発見されました。この酵素は長年、フルクトース-1,6-ビスリン酸(FBP)の無機リン酸(Pi)を切断してフルクトース6リン酸(F6P)にする反応を触媒する「FBPホスファターゼ」と思われてきましたが、実はその前段階のFBPを合成する「FBPアルドラーゼ」反応も同じ酵素が働くことがわかったのです。1つの酵素が2つの反応を担うことは、これまでの常識ではあり得ません。一体どのように反応を進めているのでしょうか。
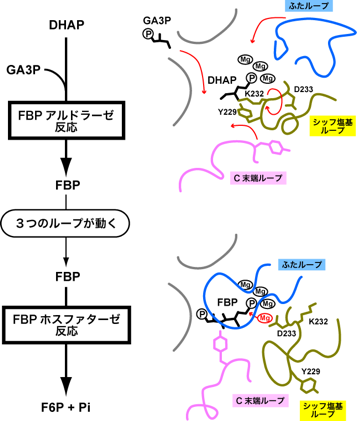 図3:FBPアルドラーゼ/ホスファターゼが触媒する反応(左側)と、反応が起こる部分の模式図(右側)
図3:FBPアルドラーゼ/ホスファターゼが触媒する反応(左側)と、反応が起こる部分の模式図(右側)この酵素は図2のように、8個のユニットが集まった形をしています。研究グループは、2004年に「FBPホスファターゼ」としての反応のしくみを立体構造解析から明らかにしていました。今回は、新たにわかったもうひとつの「FBPアルドラーゼ」反応を途中で止めた状態の結晶を作り、KEKフォトンファクトリーPF-ARのNW12Aを利用して立体構造を解明しました。図3は、2つの反応の途中でこの酵素がどのような形をしているか、酵素の「鍵穴」である活性中心付近を拡大したものです。これらの比較から、酵素が形を大きく変形させることで2つの反応を触媒していることが分かりました。まず、FBPの材料となるジヒドロキシアセトリン酸(DHAP)が活性中心に結合します。この活性中心で、DHAPは、黄色で描かれたループにあるリジン残基(K232)に結びつきます。そこにもう1つの材料グリセルアルデヒド-3-リン酸(GA3P)がやってくると、同じく黄色のループにあるチロシン残基(Y229)の助けを借りて、DHAPと結合しFBPが作られます。すると、黄色のループはFBPとの結びつきが切れて、自由に動けるようになります。黄色のループがひっくり返ると、今度はアスパラギン酸残基(D233)がFBPに近づきます。さらに、青色と桃色で描かれたループが動き、蓋のようになってFBPを閉じ込めます。アスパラギン酸はマグネシウムイオンと結合し、それが引き金となって、FBPから無機リン酸を切断し、F6Pとなります。
ループのようなフレキシブルな部分を変形させながら反応を進めている酵素は他にもたくさんありますが、こんなにもダイナミックに変身して2つの反応を行うことは実に驚きで、酵素の新たな可能性を見せてくれました。このような多機能酵素は他では発見されていません。一人二役の変身する酵素は、栄養素の乏しい原始地球で生物が生存し続けるために持っていた巧みな技なのかもしれません。
2011.10.11 プレスリリース
2種類の化学反応を触媒する酵素が「変身」する姿を世界で初めてとらえた
2007.07.05 News@KEK
原始生命の反応を探る