東京大学大学院薬学系研究科の清水敏之教授、丹治裕美大学院生、大戸梅治講師らの研究グループは、病原体由来の一本鎖RNAを感知して自然免疫系を活性化するToll様受容体8(TLR8)が一本鎖RNAを認識する様子の詳細な三次元構造を、フォトンファクトリーBL-5AおよびSPring-8を用いて世界で初めて解明しました。
私たちの体には、病原体に対する防御機構として自然免疫機構が備わっています。病原体は主にTLR受容体と呼ばれるタンパク質が感知しており、炎症反応などを起こすことで生体を病原体から守っています。TLR受容体には病原体由来の一本鎖RNAを感知するもの(TLR7とTLR8)が知られており、ウイルス感染や自己免疫疾患などの病態に関わっていることがわかっていました。しかしTLR7やTLR8がどのようにして一本鎖RNAを認識しているのかは不明でした。
今回、研究グループは、TLR8と一本鎖RNAが結合した状態(複合体)の詳細な三次元構造を放射光を用いた構造解析により高い分解能で解明しました。その結果、TLR8は一本鎖RNAだけを認識しているのではなく、一本鎖RNAと、一本鎖RNAが分解されて生じるウリジンという低分子の両者を同時に異なる部位で認識しており、これらの協調的な作用によって活性化されることがわかりました。
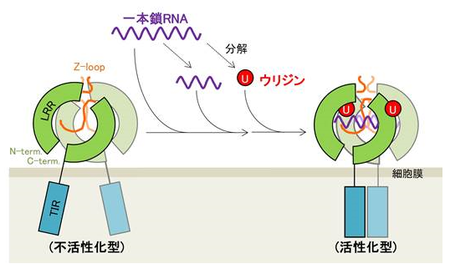
一本鎖RNAによるTLR8の活性化機構のモデル図
一本鎖RNAの分解産物であるウリジンは第一結合部位に、一本鎖RNAやその分解産物であるオリゴヌクレオチドは第二結合部位にそれぞれ結合し、協調的にTLR8を活性化する。
画像提供:東京大学大学院 清水敏之
病原体由来のRNAを認識するTLR7およびTLR8は、ウイルス感染や自己免疫疾患、さらにはがんに至るまで、さまざまな疾患に関わっていることがわかっています。これまでTLR8は一本鎖RNAを認識する受容体だと考えられていましたが、今回の結果からウリジンも同時に認識していることが明らかになりました。このことは、TLR8を標的にした創薬において、2つの部位で制御するという新しい視点を取り入れた治療薬開発に応用できると期待されます。
本成果は英国の科学誌 Nature Structural & Molecular Biology誌のオンライン版に2015年1月19日付で掲載されました。
東京大学発表のプレスリリースはこちら
論文情報:"Toll-like receptor 8 senses degradation products of single-stranded RNA"
Nature Structural & Molecular Biology (2015) DOI:10.1038/nsmb.2943