世界の人口は増え続け、今や70憶人を超えている。この人口増加を支えているのが、悪臭として知られるアンモニア(NH3)である。農作物など植物の生育には窒素(N)が必須で、その供給源としてアンモニアが使われている。アンモニアの安定供給無くして、農作物の安定供給、そして今の人口は存在し得ないと言っても良い。
その一方で、アンモニア合成には高温・高圧を必要とし、エネルギーを大量に消費していることも事実である。
植物は窒素(N)、リン(P)、カリウム(K)なしには生育できない。特に窒素はタンパク質やDNAなどの構成元素であり、生命活動に不可欠な元素。そのため、土に堆肥を混ぜたり、マメ科の植物を植えたりするなど、窒素を土壌に混ぜる方法がとられて来た。だが産業革命以降、急増する人口を賄うには足りず、19世紀に入り、窒素源を求める研究が始まった。
窒素といえば、空気の約8割を占める、非常に安定な気体(窒素分子N2)である。「非常に安定」を言い換えれば、植物が分解して利用するのが難しいということ。大量に存在する安定な窒素分子N2から、植物が体内に取り込みやすい窒素肥料として、人工的にアンモニア(NH3)を合成する研究が行われた。数多くの研究者が取り組む中で、1909年にフリッツ・ハーバーが、窒素ガスと水素ガスからアンモニアの合成(3H2+N2→2NH3)に初めて成功した。この反応を工業用に発展させたのが、カール・ボッシュ。これによって、アンモニアの大量合成が可能となり、現在もハーバー・ボッシュ法として広く利用されている。
この開発の中で、肝となる要素が触媒だった。窒素ガスと水素ガスを1対3の割合で混ぜてもアンモニアにはならない。アンモニアになるには、窒素分子の結合が切れる必要があるが、この結合は強く、なかなか切ることが出来ない。一般的には温度や圧力を上げる方法があるが、窒素分子の場合はそれでも難しい。そこで触媒が必要になる。ハーバーが最初に成功した触媒は、希少元素であるオスミウム(Os)をベースにしたものだった。高価なオスミウムは工業化には難しく、カール・ボッシュの同僚であったアルヴィン・ミタッシュによって、鉄(Fe)をベースに、カリウム(K)、アルミニウム(Al)、を加えた触媒が開発され、工業化につながった。触媒は窒素分子に電子を与えることで、結合を開裂させる。この触媒は、ハーバー・ボッシュ法が確立して以降、およそ100年以上経った現在でも使われている、触媒のチャンピオンとも言える存在。もう新たな開発要素は無いと思われていたアンモニア合成触媒の高度化に挑戦したのが、東京工業大学の細野秀雄教授だった。
細野教授は、電子を与えやすい物質として、エレクトライドという物質を開発している。その一つ、12CaO・7Al2O3(以下C12A7)は石のようなセメント構成材料でありながら、条件を変えることで半導体、金属状態、超伝導状態と多様な性質を発揮する。エレクトライドの電子を与えやすい性質を利用すれば、より簡単に窒素分子の結合を切ることが出来るのではないかと考えた。そのアイディアを元に、触媒化学の専門家である原 亨和 教授と共同研究が行われ、実験は北野 政明 准教授(写真)らが行った。北野准教授は触媒化学を専門としているが、アンモニア合成研究は初めての挑戦だった。文献調査から着手し、実用プラントでも用いられている触媒を参考にルテニウム(Ru)に注目した。元素周期表でいうと、ハーバーが使用したオスミウム、現在使われている鉄と同族元素である(図1)。エレクトライドにRuを加えると、予想通り触媒として働くことが確認された*1。驚いたのは、1気圧、340~400℃という反応条件だった。数百気圧、400~500度必要なハーバー・ボッシュ法に比べると、かなり温和な条件である。

 図1 元素周期表(*ランタノイド、**アクチノイド)。
図1 元素周期表(*ランタノイド、**アクチノイド)。高温高圧下でのみ起こると考えられていた窒素分子切断が、低温低圧下でも起こるという発見は大きな一歩であった。さらに効率を上げるため、エレクトライドに似た性質の物質を探究した。そこで注目したのがカルシウムアミド(Ca(NH2)2)という物質。カルシウムアミドにRuを加えると、C12A7エレクトライドと同様の働きをする。さらに、活性点が少ないC12A7の欠点も克服することができ、8気圧300℃の条件下でありながら、従来の10倍を超えるアンモニア合成に成功した*2。
ただし、この結果を信頼させるには、越えなければいけない壁があった。カルシウムアミドという物質は、不安定で分解されやすい物質であるため、出来たアンモニアは窒素分子からではなく、カルシウムアミドが分解してできたのではないかと考えられるからだ。触媒として働いていることを示すには、カルシウムアミドが分解されずに安定に働いていることを証明する必要があった。
そこで有効となるのがXAFS(ザフス、X-ray Absorption Fine Structure/X線吸収微細構造)。XAFSはある特定の原子周辺にある原子の種類や数、距離を調べる測定手法。KEK物質構造科学研究所の阿部 仁准教授らと共同で触媒をフォトンファクトリーのXAFSで測定し、Ruの周りの構造を調べた。するとRuから1.9Å(オングストローム、10-10m)の距離に窒素がいることが分かり、その距離から化学結合をしていると考えられた。この結合によりRuナノ粒子が安定化され、約1ヶ月間の反応に対しても安定な触媒活性を示すことが確認された。触媒反応の試験で、ここまで長期間テストするのは珍しいことだという。そのくらい緻密に証拠を固めなければ信じてもらえないほどだった、ともいえる。
他方、Ruの形状とアンモニア発生効率の関係も調べた。これまでの研究で、Ruが熱によって凝集しやすいことが報告されている。触媒反応は最表面で起こるため、凝集してドーム状になると、反応に寄与しない「もったいない」Ruがドーム内部にできてしまう。希少金属であるRuの使用量を、なるべく少量に抑えつつ、かつ効率的に働かせたい。そのための条件を調べると2nm(ナノメートル、10-9m)程度の粒径で分散させるのが最適であること、2nmより小さくなると、今度は効率が悪くなってしまうことが分かった。窒素分子や水素分子はRuの階段状の角の部分に吸着しやすく、そこで結合が切れてバラバラになる(図2)。2nmより小さくなると、階段状の部分が少なくなってしまうために、効率が低下すると考えられる。
触媒反応の詳しい仕組みなどは、まだ分かっていない部分もある。現在考えられている機構は次のようになる。まずカルシウムアミドの働きによって、電子がRuに与えられる。Ruの表面に吸着した窒素分子は、Ruから電子が与えられることで開裂する。水素分子も同様にRu表面に吸着し、分かれる。そしてバラバラになった窒素と水素がRu上で結合してアンモニアになる(図3左)。第二の経路として考えられるのが、Ru上で分かれた水素が、一度カルシウムアミドの中に入り、ヒドリドイオン(H-)を経由して、Ru上の窒素と結合するルート(図3右)。つまり触媒の母材に相当する部分も、触媒として働いている可能性がある。残念ながら反応過程の詳細は未解明だが、2つのルートの存在が、高効率な発生を実現していると考えている。
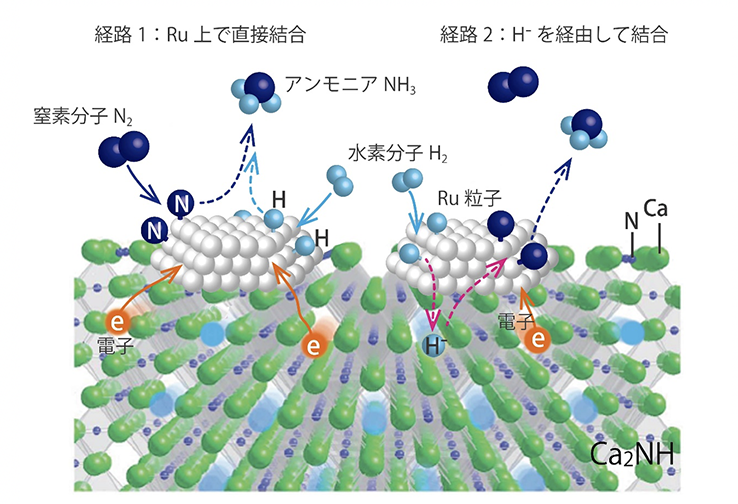 図3 アンモニア合成機構の模式図。本図はカルシウムアミドに似た物質Ca2NH上にRuを担持させたもの。カルシウムアミドでも似た機構が考えられている。
図3 アンモニア合成機構の模式図。本図はカルシウムアミドに似た物質Ca2NH上にRuを担持させたもの。カルシウムアミドでも似た機構が考えられている。これまでにない、温和な条件で合成できるこの方法は、アンモニア合成時に必要なエネルギーやコストを大幅に抑えられる可能性がある。しかし発表後には、意外なところからも反響があったという。「ハーバー・ボッシュ法は、水素生成プラントと組み合わされており、完成された方法なんです。今回の触媒は、今のハーバー・ボッシュ法に置き代わるというよりは、全く新しい展開を期待しています。」と語る北野准教授。意外な反響は、その言葉に表されるように、全く新しい展開に繋がるのだろう。
人類の食糧を下支えしてきた窒素源のアンモニアには、水素社会を見据えて関心が集まっている。水素を安全に大量に貯蔵する技術の一つとしても考えられているのだ。常温常圧で気体である水素はかさばるため、運搬貯蔵時には、高圧ガスや、低温にして液化させるなどしている。常温、微加圧条件下で液化するアンモニアは高密度に水素を貯めるキャリアにもなれるのだ。多岐にわたる可能性を秘めたアンモニア。今はまだ秘密という、意外な展開が私たちの生活を変える日も遠くないだろう。
*1 Nature Chem. 4, 934-940 (2012). Doi: 10.1038/nchem.1476
*2 ACS Catal. 6, 7577-7584 (2016). Doi: 10.1021/acscatal.6b01940
関連ページ/サイト
東京工業大学 元素戦略センター
物質構造科学研究所
放射光科学研究施設フォトンファクトリー
関連記事
2016.10.8 プレスリリース
低温で高活性なアンモニア合成新触媒を実現