真菌類などが持つ3重らせん型βグルカンを認識する仕組みを解明
#プレスリリース生体防御システムにおける3重らせん構造認識の秘密が明らかに
大学共同利用機関法人 高エネルギー加速器研究機構
本研究成果のポイント
○3重らせん型βグルカンに結合したタンパク質の立体構造を解析
○自然免疫における異物認識の仕組みが原子レベルで明らかに
○免疫調整剤の設計や真菌感染症の診断・モニタリングへの応用が可能に
独立行政法人理化学研究所(野依良治理事長)は、大型放射光施設SPring-8※1及び高エネルギー加速器研究機構(KEK)放射光科学研究施設フォトンファクトリー※2を利用して、βグルカン※3とパターン認識受容体※4の1つである「βGRP/GNBP3※5」とが結合した複合体の立体構造をX線結晶構造解析で解明し、非自己成分と特異的に結合するパターン認識受容体が、生体防御システムにおいて異物となるβグルカンの3重らせん構造を特異的に認識する仕組みを世界で初めて明らかにしました。これは、理研基幹研究所(玉尾皓平所長)糖鎖構造生物学研究チームの山口芳樹チームリーダー、金川真由美研究員、佐藤匡史研究員(現、名古屋市立大学・薬学部准教授)らと東京薬科大学の大野尚仁教授、安達禎之准教授らとの共同研究による成果です。
グルカンはグルコースが直鎖上に連結した重合体(ポリマー)で、天然に最も多く存在する多糖です。β結合でつながったβグルカンは真菌類や植物の細胞壁などに多く存在しますが、ヒトなどの哺乳類には存在しません。生体防御システムの1つである自然免疫※6では、パターン認識受容体が、βグルカンなどの異物を認識することから免疫応答が働き始めます。βグルカンは、X線回折や固体NMRなどの解析により3重らせん構造を形成していることが示されてきましたが、パターン認識受容体がこの構造を特異的に認識する仕組みは明らかとなっていませんでした。
研究グループは、3重らせん構造を形成しているβグルカンと特異的に結合するパターン認識受容体「βGRP/GNBP3」に着目し、βグルカンとの複合体の立体構造を解析しました。その結果、βGRP/GNBP3は多数のアミノ酸残基からなる幅広い結合面を利用してβグルカンの3本鎖を全て認識する、という極めてユニークな仕組みを備えていることが分かりました。
今回明らかとなった3重らせん構造認識の仕組みは、βグルカンの免疫調整剤としての機能を高める合理的薬剤設計など薬学分野へ貢献するだけでなく、血中や体液中のβグルカンを検出するためのツールの開発に役立ち、真菌感染症の診断やモニタリングへの応用など医療分野への貢献も期待されます。
本研究成果は、米国の科学雑誌『The Journal of Biological Chemistry』(オンライン版6月22日)に掲載されました。
1.背 景
セルロース、アミロース、βグルカンなどの多糖は、構成糖の結合様式や水素結合のパターンなどによってさまざまな構造をとることが知られています。酵母などの真菌類や植物の細胞壁の構成成分として知られるβグルカンは、X線回折や固体13C-NMRなどの物理化学的手法により3重らせん構造を形成していることが示されてきました。これまでに、1本のβグルカン鎖が残りの2本のβグルカン鎖と水素結合を形成しているモデルが報告されています。
生体防御システムでは、βグルカンは非自己成分としてパターン認識受容体に認識されます。これまでの研究から、βグルカンに結合するパターン認識受容体の多くは、3重らせん構造を形成しているβグルカンとだけ結合することが知られていました。パターン認識受容体の1つであるβGRP/GNBP3も、3重らせん構造を形成しているβグルカンとは結合しますが、1本鎖のβグルカンとはほとんど結合しないことが知られています。しかし、βGRP/GNBP3をはじめとするパターン認識受容体が、βグルカンの3重らせん構造を特異的に認識する仕組みは明らかになっていませんでした。
今回研究グループは、βGRP/GNBP3のβグルカン結合ドメイン※7とβグルカンとの複合体の立体構造を解析し、βグルカンの3重らせん構造を特異的に認識する仕組みの解明に挑みました。
2.研究手法と成果
X線結晶構造解析を行うため、カイコ及びノシメマダラメイガのβGRP/GNBP3のβグルカン結合ドメインを大腸菌で大量に発現させ、このタンパク質を用いてさまざまな種類や長さのβグルカン鎖との複合体の結晶化スクリーニング※8(約2,600条件)を行いました。その結果、βGRP/GNBP3のβグルカン結合ドメインと6つのグルコースからなるβグルカン鎖との複合体を結晶化することに成功しました。
この結晶化に成功した複合体について、大型放射光施設SPring-8のビームラインBL26B2にて良質なX線回折データを与える結晶のスクリーニングを迅速に行い、高エネルギー加速器研究機構(KEK)フォトンファクトリーのビームラインBL5A、NW12-A及びNE-3Aで最終的なX線回折データの収集を行いました。これらの実験により、βGRP/GNBP3のβグルカン結合ドメインとβグルカン鎖の複合体の立体構造を解明しました(図1)。βグルカン鎖との相互作用に関与しているβGRP/GNBP3上のアミノ酸残基は、立体構造上広範囲に分布していることが分かりました。また、結晶中の複合体では、βグルカン鎖は3重らせん様の構造を形成し、これまで報告されてきたモデルをほぼ忠実に反映していました(図2)。
結晶中で見られたβGRP/GNBP3とβグルカン鎖の相互作用が水溶液中でも起きていることを確認するため、βグルカン鎖と直接相互作用しているβGRP/GNBP3上のアミノ酸残基(H31, L41, R48, D49, W76, Y78, R87)のそれぞれについて変異体を作製しました。これらの変異体を用いてβグルカン鎖との結合実験を行った結果、βGRP/GNBP3の変異体の大部分は、βグルカン鎖との結合能を失っていることが分かりました。この結果は、これら広範囲に分布するアミノ酸残基が水溶液中でもβグルカン鎖と相互作用することを示すとともに、いずれのアミノ酸残基もβグルカンの認識に重要であることを示しています。また、D49のように同時に1本以上のβグルカン鎖と相互作用しているアミノ酸残基の存在も明らかとなり、βGRP/GNBP3が多数のアミノ酸残基を利用してβグルカンの3本鎖全てを認識する、という極めてユニークな仕組みを備えていることを突き止めました(図3)。
これらの結果から、パターン認識受容体が多数のアミノ酸残基からなる幅広い結合面を利用してβグルカンの3本鎖を認識することによって、βグルカンの3重らせん構造を特異的に認識する仕組みが世界で初めて明らかになりました。
3.今後の期待
βグルカンなどの多糖は、免疫調節剤として機能することが報告されています。また、βグルカンの抗がん作用や抗感染作用は、βグルカンの立体構造に依存することが知られています。今回の成果で明らかとなった3重らせん構造認識の仕組みを基に、分岐糖鎖の導入や修飾によりβグルカンの合理的な薬剤設計が実現します。また、こうした薬学分野への貢献だけでなく、この仕組みを活用して血中や体液中のβグルカンを検出するツールを開発することで、アスペルギルス症※9などの真菌感染症の診断やモニタリングへの応用にもつながると期待されます。
【報道担当・問い合わせ先】
- (問い合わせ先)
- 独立行政法人理化学研究所
基幹研究所 ケミカルバイオロジー研究領域
システム糖鎖生物学研究グループ
糖鎖構造生物学研究チーム
チームリーダー 山口 芳樹(やまぐち よしき)
TEL:048-467-9619 FAX:048-467-9620
- (報道担当)
- 独立行政法人理化学研究所
広報室 報道担当
TEL:048-467-9272
FAX:048-462-4715 - 大学共同利用機関法人
高エネルギー加速器研究機構
広報室長 森田 洋平
TEL:029-879-6047
FAX:029-879-6049
【補足説明】
- ※1 大型放射光施設SPring-8
- 理研が所有する、兵庫県の播磨科学公園都市にある世界最高の大型放射光施設。SPring-8の名前はSuper Photon ring-8GeV に由来する。放射光(シンクロトロン放射)は、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する指向性の高い強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。日本の先端科学・技術を支える高度先端科学施設として、日本国内外の大学・研究所・企業から年間約1万4千人(2010年度実績)の研究者が利用している。
- ※2 フォトンファクトリー
- 光(Photon)の工場(Factory)の愛称で親しまれているPFは日本初のX線を利用出来る放射光専用光源として、1982年に完成した。数度の大改修を経て輝度を高めるとともに、最新技術の実験装置の整備により、世界最先端の研究成果を創出している。
このような大型施設は、大学などが単独で維持管理することが難しいため、大学や研究機関が共同で利用実験するための施設(大学共同利用機関)としてKEKで運用している。 - ※3 βグルカン
- グルコースがβ結合でつながったポリマー。酵母などの真菌類、糸状菌(かび)や植物の細胞壁の構成成分となっている。ヒトなどの哺乳類は合成する能力を有していない。
- ※4 パターン認識受容体
- 非自己成分と特異的に結合するタンパク質。
- ※5 βGRP/GNBP3
- β−Glucan recognition protein / gram-negative bacteria-binding protein 3の略で、βグルカンと結合するパターン認識受容体の1つ。
- ※6 自然免疫
- 非自己成分をパターン認識受容体によって認識し、排除する生体防御システム。
- ※7 βグルカン結合ドメイン
- βGRP/GNBP3のうち、βグルカンと結合する領域(ドメイン)のこと。ドメインはタンパク質において機能を発現するための立体構造の単位となる。
- ※8 結晶化スクリーニング
- X線結晶構造解析に用いるタンパク質の結晶を得るために、通常数百の沈殿剤の条件でスクリーニングを行うこと。
- ※9 アスペルギルス症
- アスペルギルス属の真菌の感染が原因となる感染症の総称。
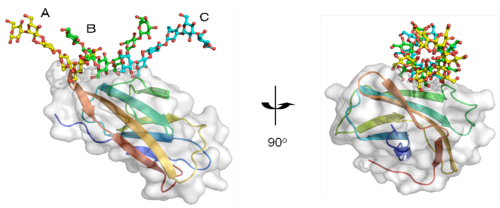
図1
βGRP/GNBP3が3本鎖βグルカンを認識する様子
3本のβグルカン鎖(A、B、C)が3重らせん様の構造を形成し、βGRP/GNBP3と相互作用している。βグルカン鎖と相互作用するβGRP/GNBP3上のアミノ酸残基は広範囲に分布している。
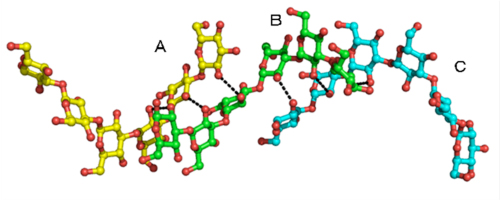
図2
3重鎖βグルカン鎖に見られる水素結合パターンの様子
βGRP/GNBP3のβグルカン結合ドメインと相互作用するβグルカン鎖は、1本のβグルカン鎖(B)が残りの2本のβグルカン鎖(AとC)と水素結合(点線)を形成しており、これまでの報告されてきたモデルをほぼ忠実に反映している。
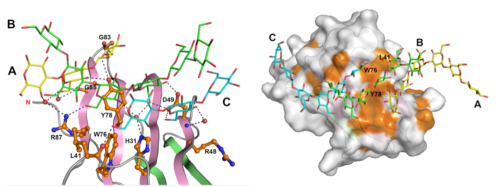
広範囲にわたる多くのアミノ酸残基によって3重鎖βグルカンを認識する
(左)βGRP/GNBP3は、広範囲に分布するアミノ酸残基を利用してβグルカンの3本鎖全てを認識している。D49は2本のβグルカン鎖(BとC)と水素結合(点線)を形成している。
(右)βGRP/GNBP3の分子表面にある疎水性残基(オレンジ)の集まり。L41、W76、Y78を含む疎水性残基がβグルカンとの結合面を形成している。
-
カテゴリで探す
-
研究所・施設で探す
-
イベントを探す
-
過去のニュースルーム