全世界のがん死亡原因の第二位を占める胃がんは、毎年約70万人もの命を奪っています。中でも日本は胃がんの最多発国で、予防や治療に関する研究が盛んに行われています。胃がんの発症に重要な役割を担うピロリ菌は、世界人口の半数以上が感染していると言われています。そして近年、ピロリ菌が産生するタンパク質「CagA」が、胃の細胞内に侵入することでヒトが持っている様々なタンパク質と結合し、それらの機能を撹乱することで胃がんの発症を誘導することが明らかになってきました。胃がん予防の鍵となるタンパク質としてCagAは大きく注目されるようになりました。
CagAは約1,200個のアミノ酸が一本鎖に繋がり、折りたたまれてできた大きなタンパク質です。このアミノ酸の配列を調べていくと、タンパク質の端であるC末端領域にCMモチーフとEPIYAモチーフと呼ばれる特徴的なアミノ酸の繰り返し配列が存在していました(図1)。
 図1 CagAの構造模式図。
図1 CagAの構造模式図。CagAは、以下のようなしくみで胃がんを引き起こすと言われています。ピロリ菌内で産生されたCagAは、その後ピロリ菌の持つ微小な注射針のような装置を通って胃の細胞内に侵入します。侵入したCagAは細胞膜の構成成分であるホスファチジルセリンと相互作用することで、細胞膜の内面に結合します。細胞膜の内面に結合したCagAは、胃の上皮細胞で働くPAR1という酵素とCMモチーフの部分で結合して、この酵素の働きを抑えます。上皮細胞や神経細胞などは、1つの細胞の中で機能が違う部分が存在し、これを細胞極性と呼びますが、PAR1はこの極性を制御している酵素です。CagAはPAR1の働きを抑えることで、胃粘膜の構造を破壊してしまうことがわかっています(図2左)。
同時にCagAは、EPIYAモチーフ中のチロシン残基がリン酸化修飾を受けることにより、ヒトのがんタンパク質として知られるチロシンホスファターゼSHP2と結合できるようになります。SHP2はCagAと結合すると異常に活性化され、細胞のがん化につながる異常な分裂・増殖シグナルを発します(図2右)。
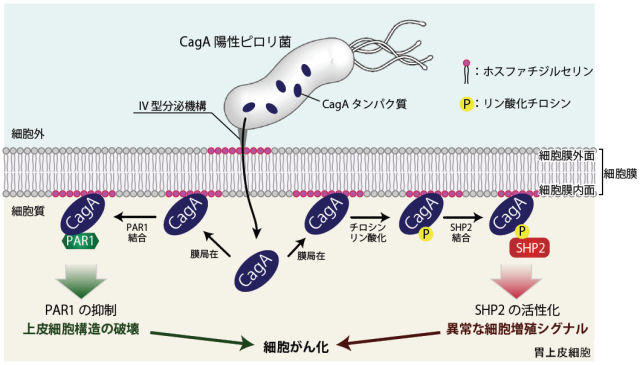 図2 ピロリ菌 CagAによる細胞内シグナルの撹乱(東京大学プレスリリースより)
図2 ピロリ菌 CagAによる細胞内シグナルの撹乱(東京大学プレスリリースより)このように、ピロリ菌が産生するCagAは、胃の細胞内に侵入し、CMモチーフとEPIYAモチーフを巧みに使ってヒトが本来持つ様々な分子機能を撹乱することで胃の細胞をがん化すると考えられています。CagAが「がんタンパク質」として働くための分子機構を明らかにするため、産業技術総合研究所・バイオメディシナル情報研究センターの千田俊哉 主任研究員と東京大学大学院医学系研究科の畠山昌則教授のグループは、X線結晶構造解析の技術を駆使してCagAの立体構造を調べました。
CagAの約1,200個のアミノ酸配列を分割して調べていくと、これらのアミノ酸全てが決まった形に折り畳まれているのではなく、C末端側の830番目から1186番目までの領域では決まった立体構造を持たない「天然変性領域」となっていることが分かりました。X線結晶構造解析を行うには、全く同じ構造をしたタンパク質を並べた結晶を作ることが不可欠で、個々に自由な形状をしている天然変性領域が含まれていると、結晶を作ることが困難です。そこで千田さんらは、まず決まった立体構造を持つ1番目から829番目の領域「CagA-N領域」の立体構造解析を行いました。その結果、CagA-N領域は3つの構造ドメインがN字型に構成された、これまでに知られているどのタンパク質とも似ていない新規の立体構造であることが明らかになりました(図3)。そして、CagA分子の中央部には多数の塩基性アミノ酸が集まってプラスの電荷を持つ部分(塩基性パッチ)があることがわかりました(図4)。この塩基性パッチは、マイナス電荷を持つホスファチジルセリンと静電的な相互作用をすることで、細胞膜と結合していることが分かりました。
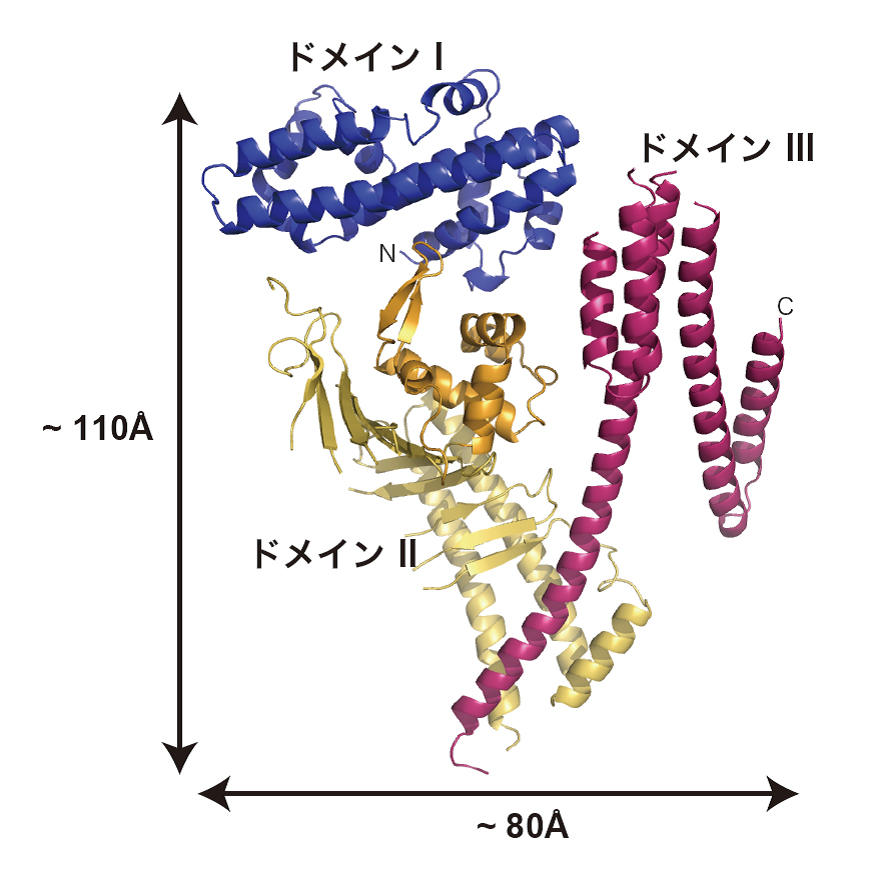 図3 CagA-Nの結晶構造。
図3 CagA-Nの結晶構造。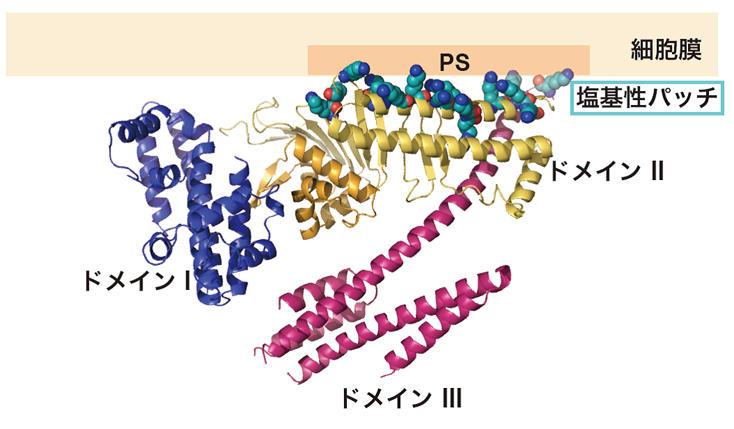 図4 CagAと細胞膜の相互作用。
図4 CagAと細胞膜の相互作用。決まった構造を持つCagA-N領域とは異なり、830番目から1186番目までの「CagA-C領域」は状況に応じてその構造を自由自在に変化させることができる「天然変性領域」と呼ばれる部分です。「天然変性領域」は、構造を変えながら様々なタンパク質と結合するため、一般的に細胞内の情報伝達に重要な働きをすると考えられています。実際、CagAにおいても、細胞極性を制御するPAR1と結合するCMモチーフ、細胞の分裂・増殖を制御するSHP2と結合するEPIYAモチーフはこの天然変性領域にあります(図1)。この領域を詳しく調べていくと、その一部が、決まった構造を持つCagA-N領域の一部と相互作用をすることで、投げ縄状のループが形成されることが明らかになりました(図5)。この投げ縄状の構造が形成されると、CagAとPAR1やSHP2との間で形成される複合体が安定化し、より強いがん化シグナルが生成されることが明らかになったのです(図6)。このことから、CagA-N領域とCagA-C領域との間で生じる相互作用は、発がん活性を上げるための分子内スイッチとして働くのではないかと考えられます。
CagAとPAR1、SHP2との相互作用、そしてその相互作用をより強くする投げ縄構造は、ピロリ菌による胃がん発症の重要な鍵を握っています。分子レベルでこの仕組みが明らかになったことは、ピロリ菌が引き起こす胃がんの発症を抑える薬の開発につながると期待されます。
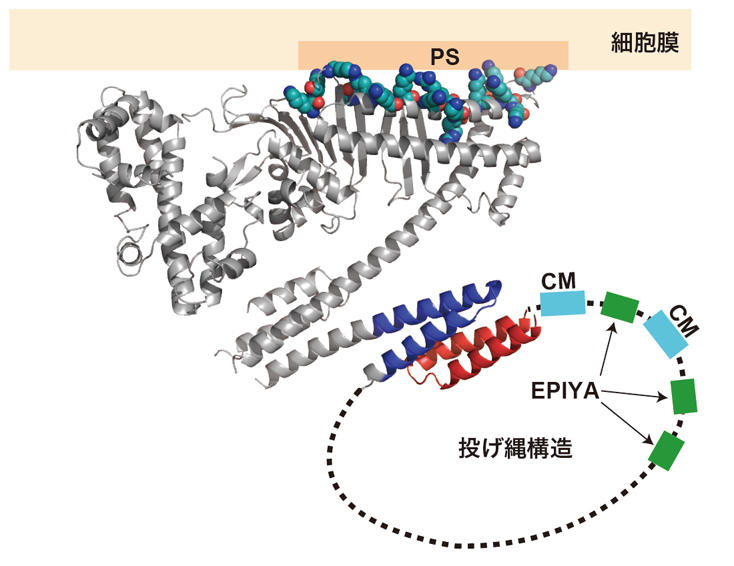 図5 CagAのC末端領域に見いだされた投げ縄構造。
図5 CagAのC末端領域に見いだされた投げ縄構造。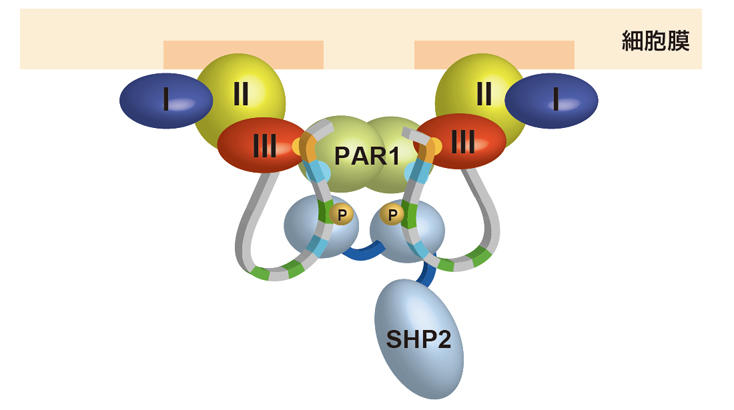 図6 細胞内膜上に形成されると考えられる複合体。
図6 細胞内膜上に形成されると考えられる複合体。このタンパク質の立体構造解明には、技術的な工夫と、多くの結晶試料が用いられました。CagA結晶から得られた初めての回折パターンは10Å(オングストローム、1Åは100億分の1メートル)分解能程度しかなく、高分解能の構造解析には不向きなものでした。しかし、約1年半にわたり結晶の質を改善し、X線損傷を最小に押さえるためのデータ測定法の工夫、低分解能のデータからモデルを構築するための工夫などを重ねた結果、少しずつデータの質が改善されていき、最終的には3.3Å分解能のデータが収集でき、構造決定が可能になったのです。構造決定までに凍結した結晶の数は2,000個以上、X線を当てた結晶の数は1,000個以上にもなりました。このような大量の結晶を用いて条件を改善していく解析には、高強度の放射光は無くてはならない必要不可欠なものです。千田さんは、この経験から、「質の悪い結晶であっても、詳細な条件検討を効率よくこなしていく事で、結晶の質を改善できることが多いと考えています。」と話しています。
関連サイト放射光科学研究施設 フォトンファクトリー
産業技術総合研究所・バイオメディシナル情報研究センター
東京大学大学院医学系研究科 微生物学研究室
構造生物学研究センター
タンパク質構結晶造解析ステーション
東京大学 プレスリリース
胃がんを引き起こすピロリ菌がんタンパク質の立体構造解明
2010.9.16 ハイライト
DNAを読むしくみの解明
2007.3.1 News@KEK
染色体の構造を変換する