「水素元年」と位置付けられた2015年、水素社会が本当に実現するか否か、今後5年でよりくっきり見えてくるだろう。4月には東京の芝公園に商用水素ステーションが登場し、政府は今年度中に、全国100か所にまで増設する計画を発表している。
石油などエネルギー資源の乏しい日本にとって、水素を活用することは、エネルギー問題、環境問題にとって重要な課題となっている。水素は酸素と反応して水になると同時に電気を作りだす。このようにして発電するものを燃料電池といい、その電気で駆動する自動車を燃料電池自動車という。
水素の活用には大きく3つの段階、①製造、②貯蔵・輸送、③利用がある。今回、注目するのは"貯蔵・輸送"だ。この開発で重要なのは、同じ体積に出来るだけ高密度に水素を集めること。現在、主に用いられているのは、液化水素や、700気圧で押し込めた高圧水素ガスで、どちらも水素だけを詰め込む方式。これに対し、金属など他の元素に水素をつけて固体として貯蔵するのが、水素貯蔵材料。驚くことに、水素だけを凝集させるより、金属など別の元素と結合させた方が、高密度に水素を貯蔵できるという。一般に気体、液体、固体と高密度になるが、それに加え、水素の状態が鍵になっている。
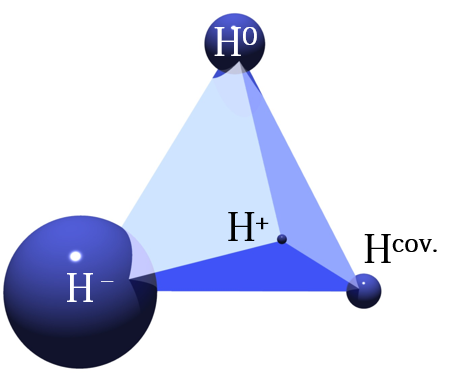 図1 水素ダイアグラム
図1 水素ダイアグラム水素は、陽子と電子が一つずつ、という最もシンプルな構成をした元素。それ故に、電子一つの出入りによって大きさ(イオン半径)が全くと言って良いほど変わる。電子が一つ抜けると陽子一つ(H+)となり、イオン半径はほぼゼロ(大きさの定義は諸説あり)になる。逆に電子が一つ加わると(H-)、電子は広がり、その半径は中性水素のおよそ2.5倍にもなる。つまり水素は状態によって半径で十数万倍、体積では数千兆倍にも変わる、何とも奇妙な元素なのだ。その水素の魅力に引き込まれ、研究をしているのが折茂(おりも)慎一教授(東北大学原子分子材料科学高等研究機構(WPI-AIMR)/金属材料研究所)。図1は、この変幻自在な水素を一目で表そうと折茂氏が考案、提唱したもの。
ダイナミックに変化する水素の性質を理解し、かつ、なるべく軽い金属に沢山の水素を結合させることが水素貯蔵には重要となる。水素は元来、様々な元素と結合しやすい元素だが、どうしても結合しない元素群がある。元素周期表6~12列のエリアでハイドライド(水素化物)ギャップと言われる。このギャップを埋める研究が進められ、高圧力下で水素との化合物が報告されてきた(図2)。そして最後に1つ、クロムだけが水素と結合しない最後のギャップとして残っていた。
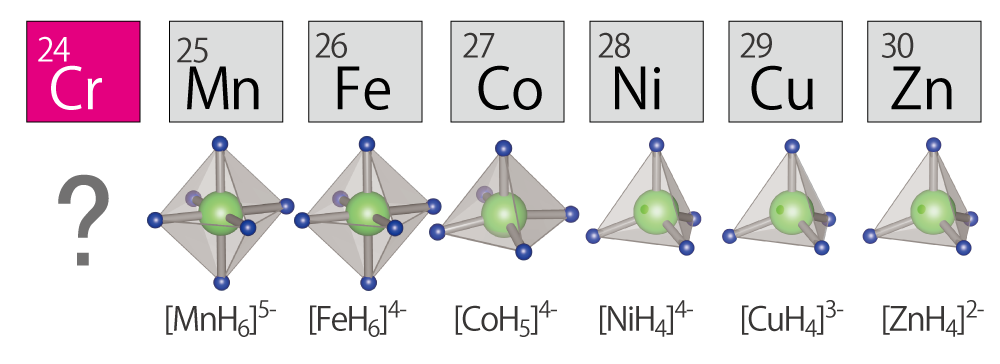 図2 ハイドライド・ギャップ
図2 ハイドライド・ギャップ
遷移金属が水素と結合して形成する錯イオン群(画像提供:東北大学 高木成幸)
「なぜクロムだけが水素と結合しないのか、その理由が分からなかった。」このギャップ克服に挑んだ理由を話すのは、折茂研究室の髙木成幸助教。髙木氏は第一原理計算等を用いた理論を専門としている。「まずは頭の中で想像するんです。」と語り始める。これまでに報告されている水素化物を周期表に当てはめ、並べていく。「ニッケル(Ni)は水素が4個、コバルト(Co)は水素が5個、鉄(Fe)は水素が6個、マンガン(Mn)は水素が7個でくっつく。ということは、クロムでは水素8個が良さそうだと予測できます。」同様にマグネシウム(Mg)についても並べると、Mg3CrH8と予想が付く。次に電荷の合計がゼロになる組み合わせを考える。クロム一つに対して水素7個結合させると、[CrH7]で5-、周辺に2+のマグネシウムを三つ配置させると、合計1+、余った水素一つと合わせてゼロになる。無理のない組み合わせが出来たところで、計算機にかけ、安定な構造を導き出す(図3)。構造の安定性とその条件が得られると、試料合成にバトンが渡される。
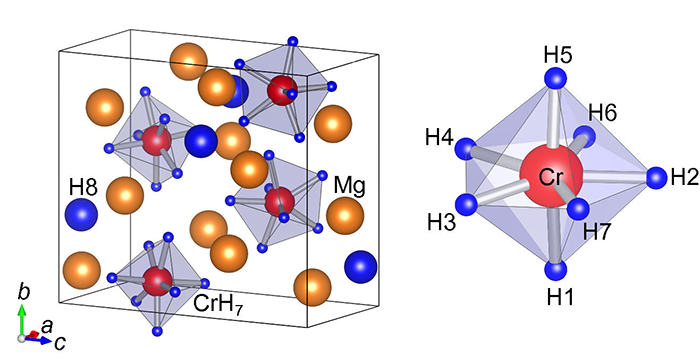 図3 理論予測された[CrH7]5-イオンを含む錯体水素化物Mg3CrH8の結晶構造(左)とクロムに7つの水素が結合したCrH7イオン(右)
図3 理論予測された[CrH7]5-イオンを含む錯体水素化物Mg3CrH8の結晶構造(左)とクロムに7つの水素が結合したCrH7イオン(右)合成を行ったのは、研究室に来てまだ日も浅い飯島祐樹氏。研究室の打合せで髙木氏の報告を聞き、合成に取り組んだ。クロムとマグネシウム水素化物の粉末を混ぜ、それを高圧装置用の直径1 mm程のカプセルに入れる(図4)。カプセルの上下を水素供給源のペレットで挟み、さらにその外側を電極の付いた炭素カプセルで覆う。これを1cm立方ほどのセルに埋め込み、電流を流しながら圧力をかける。こうして、5万気圧、700℃の状態を作りだし、試料を合成した。できた試料はまず、X線回折で構造を調べる。X線は電子に散乱されるため、金属のクロム、マグネシウムの位置を検出できる。次に赤外線を照射して、分子の振動を調べる(ラマン散乱)。直接水素を見ることができない代わりに、水素を振動させて、その振動モードからクロムとの結合の強さ、個数などを調べる。これらの結果は、すべて髙木氏の行ったシミュレーションと見事に一致していた。「できた、ということはほぼ確信しました。でも、科学的に信頼性を高くするには、直接観測によって水素の位置を決定しないとダメなんです。」
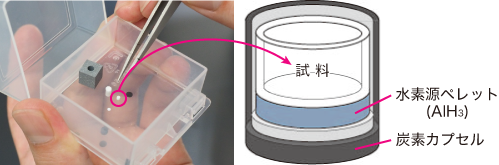 図4 高圧合成用のセル
図4 高圧合成用のセル
水素を直接観測して、位置を決定するには、中性子が有効な手段となる。電荷を持たない中性子は、今回のように、水素が金属中にある場合でも、金属原子の巨大な電子雲に阻まれることなく、水素の原子核に到達できる。その性質を利用した装置がJ-PARCの物質・生命科学実験施設にあるNOVA(図5、高強度中性子全散乱装置)。KEK物構研の大友季哉教授を中心とするグループにより、設計・建設された装置で、特に水素貯蔵材料中にある水素を見るのを得意としている。試料は直径1 mm程のペレット状、重さにして57 mg。中性子実験の試料としては驚くほど小さく、微量である。それでも測定に要したのは2時間ほど。装置名に「高強度」と冠するように、中性子の強度がとても強いためである。J-PARCのような大強度中性子ビームによって、理論による材料予測→合成→検証という水素貯蔵材料創製プロセスの最後の一手が打てるようになった。試料によって散乱された中性子のデータを解析すると、水素とクロムの距離など原子配列が分かる。これもまたX線回折実験や、髙木氏の計算とも一致し、クロムに水素が7つ結合したと明確に示された。「本当に、特段の工夫をすることもなくデータが取れたんです。」と語るのは池田一貴特別准教授(KEK物構研)。「試料の質が良かったのでしょう。」とその理由を語った。結晶の場合、少しだけ構造の異なるものも一緒に出来てしまう場合がある。そういった試料を測定すると、構造を決めることが難しくなるからだ。
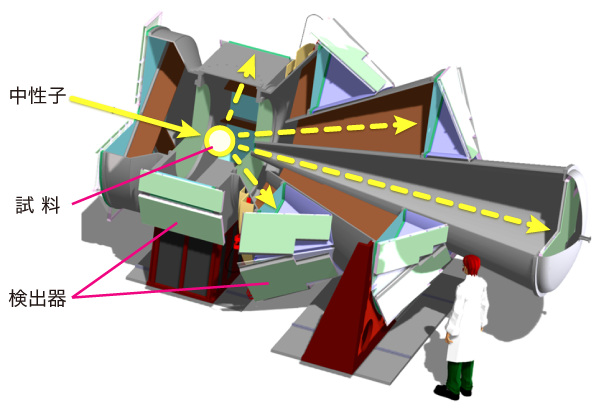 図5 高強度中性子全散乱装置NOVA
図5 高強度中性子全散乱装置NOVA
クロムとの水素化物が出来たことは、物性としても、応用面としても功績が大きい。唯一水素と結合できずに残っていた、最後のハイドライド・ギャップを克服したこと。しかも質量あたりの水素含有量は6.1 wt%と、これまでの最高記録とほぼ同等で水素貯蔵材料として有望な値を指している。また今回は一つのクロムに7個の水素を結合させたが、理論的には8個、9個とさらに多くの水素を結合させることも可能だという。もちろん、水素貯蔵材料としての実用化には合成方法や、水素をスムーズに放出入する機構など、まだまだ課題はある。他方、この水素化物は常温超伝導への扉を開けようともしている。水素は木星や土星のような巨大惑星の中心部、つまり超高圧状態では金属状態(金属水素)で存在すると言われている。金属水素は常温近くで超伝導を示すことが予測されており、多くの研究者が好奇心を掻き立てられてきた。残念ながら、これまで巨大惑星中心部の環境を再現するには至っていないが、9個もの水素が結合して凝集した水素化物であれば、現在の技術でも金属水素と同様の状態が作りだせる可能性があるという。
水素の可能性を十分に引き出すことができれば、世界は本当に変わるのかもしれない。
 左から:折茂慎一教授、佐藤豊人助教、髙木成幸助教、飯島祐樹氏、高圧合成装置(Hy-Dra)
左から:折茂慎一教授、佐藤豊人助教、髙木成幸助教、飯島祐樹氏、高圧合成装置(Hy-Dra)
東北大学 折茂研究室
J-PARC 物質・生命科学実験施設
物質構造科学研究所
中性子科学研究系
高強度全散乱装置NOVA
2015.3.24 物構研トピックス
クロムに水素を7つ結合、新しい水素貯蔵材料へ
2013.5.23 ハイライト
燃料電池自動車のカギ、水素貯蔵のしくみ
2012.5.7 プレスリリース
岩塩(NaCl)構造をもつレアアースメタルの水素化物を発見