東京大学大学院農学生命科学研究科の伏信進矢教授らの研究グループは、新潟大学大学院自然科学研究科の中井博之准教授らと共同で、セルロースからバイオ燃料となるエタノールができるまでの経路にある酵素CBAPの立体構造をフォトンファクトリー(PF)のX線結晶構造解析により初めて解明しました。
植物の細胞壁などに多く含まれるセルロースから得られるエタノールは、デンプンなど食糧と競合しない、再生可能な生物資源と目されています。セルロースの分解には、微生物が作る加水分解酵素(セルラーゼ)が古くから研究されていました。近年、その効率を飛躍的に増大させる酸化的セルロース分解酵素が発見され、注目されています。これらの酵素により、セルロースはセロビオン酸に分解されますが、その後、どのように分解されていくのか、全く分かっていませんでした。そうした中、2013年、新潟大の中井准教授らの研究グループにより新しい酵素「セロビオン酸ホスホリラーゼ(CBAP)」が発見されました。CBAPがセロビオン酸に作用するとエタノール等の生成材料になる、化合物に分解されます。
今回、研究グループは、CBAPの立体構造をPFのBL‐17AとNW-12Aを利用して、X線結晶構造解析により初めて解明しました(図1)。さらに、セロビオン酸と結合した状態のCBAPの構造を決定し(図2)、その作用メカニズムを詳細に明らかにしました。
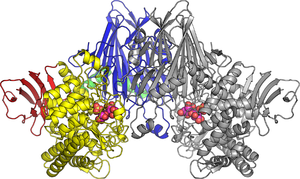
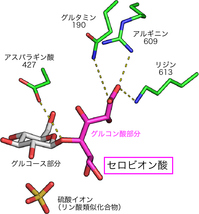
その結果、セロビオン酸の結合部位のうち、グルコース部分の結合に関わる部分は他の類似酵素と似ていましたが、グルコン酸部分の結合に関わる部分は全く新しい構造であることが分かりました。さらに、点変異体を用いた機能解析により、基質の結合に重要な箇所やセロビオン酸の切断に触媒的に重要な箇所なども解明しました。
本成果は、微生物を利用してセルロースを分解し、エタノールなどのバイオ燃料や様々な化合物を発酵生産する技術開発に有用な知見となります。また、今回解明したCBAPは微生物による酸化的セルロース分解と発酵の代謝経路をつなぐ、いわば「ミッシングリンク(失われた環)」であり、この解明は学術的にも重要な情報をもたらしました。
本成果は、journal of Biological Chemistryの7月24日号(電子版6月3日)に掲載されました。
東京大学からのプレスリリースはこちら
Title:"Crystal structure and substrate recognition of cellobionic acid phosphorylase playing a key role in oxidative cellulose degradation by microbes"[ DOI:10.1074/jbc.M115.664664 ]
Authers:Young-Woo Nam, Takanori Nihira, Takatoshi Arakawa, Yuka Saito, Motomitsu Kitaoka, Hiroyuki Nakai, and Shinya Fushinobu