東京大学放射光連携研究機構の深井 周也 准教授らは、癌抑制タンパク質と免疫応答に関わるポリユビキチン鎖が結合した状態の立体構造をKEKフォトンファクトリーを利用し決定、癌抑制タンパク質が2つの異なるポリユビキチンを切断している様子を解明しました。
ポリユビキチン鎖とは、ユビキチンというアミノ酸76個から成る小さなタンパク質がつながってできたものです。ユビキチンは、細胞の中などあらゆる組織に存在し、タンパク質の分解や修復などの「めじるし」として結合し、生命活動を担うものです。このユビキチンがいくつもつながったポリユビキチン鎖は、つながり方の違いによって、異なる生体反応を制御します。この中で、先頭のメチオニン(Met1)でユビキチン同士がつながったポリユビキチン鎖や、63番目のリジン(Lys63)でつながったポリユビキチン鎖は、癌抑制タンパク質CYLDにより適切に切断されなければ、過剰な免疫応答を引き起こし、腫瘍形成や細胞の癌化へと進展することが知られています。しかし、Met1でつながったポリユビキチン鎖と、Lys63とでつながったポリユビキチン鎖では、構造が異なり、CYLDが双方をどのように区別して認識し、切断しているのかは不明でした。
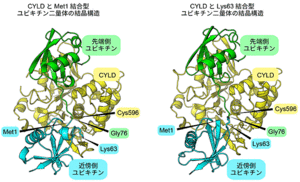
図1(左)Met1結合型、および(右)Lys63結合型の立体構造
どちらもCYLD(黄色)は先端側ユビキチン(緑)、近傍側
ユビキチン(水色)と同時に結合し、切断部分と596番目の
システイン(Cys596)が接近している。2つの構造中で、
近傍側ユビキチンの向きだけわずかに異なる。
深井准教授らは、ユビキチンが二つつながった二量体のポリユビキチンを使用し、癌抑制タンパク質CYLDとMet1でつながったポリユビキチン鎖とが結合した状態(Met1結合型)、およびCYLDとLys63でつながったポリユビキチン鎖とが結合した状態(Lys63結合型)をフォトンファクトリーのBL-1Aと17AおよびSPring-8のBL41XU、32XUで調べ、立体構造を解明しました(図1)。その結果、Met1結合型、Lys63結合型のどちらの複合体でも、CYLDは二量体両方のユビキチンの形を同時に認識し、CYLDの596番目のシステイン(Cys596)がポリユビキチン鎖をちょうど切断する位置にあることが分かりました。Met1結合型とLys63結合型とでは、ユビキチン同士のつながり方が異なり、CYLDと結合しているユビキチンの向きはMet1結合型とLys63結合型で変わるにも関わらず、CYLDだけに特別に存在する柔軟な領域が、両型のユビキチンと相互作用できるように変化し、それぞれのポリユビキチン鎖を切断できることが明らかになりました。これは、これまでには報告されていない、選択的にポリユビキチン鎖を認識する新しいメカニズムです(図2)。
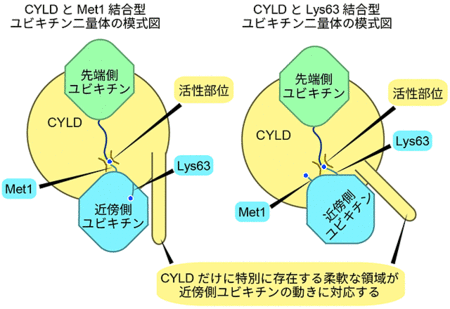
図2 CYLDと、Met1結合型およびLys63結合型ポリユビキチン鎖とが結合した状態の模式図
2つの構造中で、近傍側ユビキチンの向きだけわずかに異なるが、CYLDだけに特別に存在する柔軟な領域が、近傍側ユビキチンの向きが変わっても近傍側ユビキチンと常に結合している。
このため、CYLDはMet1結合型とLys63結合型ポリユビキチン鎖のどちらも切断できる。
癌抑制タンパク質であるCYLDの機能解明は癌や腫瘍抑制メカニズムの理解につながるものであり、ポリユビキチン鎖を生命がどのように識別しているのかを明らかにすることで、免疫応答や炎症反応を司るポリユビキチン鎖の機能について理解を深めることができます。本成果は、米国の科学雑誌Nature Structural & Molecular Biologyに掲載されました。
東京大学発表のプレスリリースはこちら