岩手医科大学薬学部の阪本泰光助教、昭和大学薬学部の田中信忠准教授、長岡技術科学大学の小笠原渉准教授、JAXAの太田和敬主任開発員らの研究グループは、歯周病原因菌の増殖や病原性に関与する酵素PgDPP11の立体構造をフォトンファクトリー、SPring-8を用いた放射光X線回折実験により明らかにしました。
歯周病は、世界中で最も感染者数の多い感染症であり、口腔疾患だけでなく、糖尿病や動脈硬化などの全身疾患の悪化への関与も指摘されています。歯周病原因菌の一つであるPorphyromonas gingivalisは、炭水化物ではなく、タンパク質やペプチドを栄養源とする糖非発酵性グラム陰性細菌*1です。この菌が持つ酵素が、タンパク質やペプチドを分解し、エネルギーとして吸収する様子を分子レベルで理解することは、それらを阻害して菌の生育を妨げるという仕組みの薬物の開発に役立つと考えられています。
阪本助教らのグループは、ヒトに影響を与えず病原体だけに大きなダメージを与えるため、ヒトに存在しないS46ファミリーというペプチド分解酵素類を標的とした抗生物質の開発に取り組んでいます。昨年、S46ファミリーに属し疎水性アミノ酸を認識して切断するDAP BIIという酵素の立体構造解析に成功し、S46ファミリー酵素に共通の全体構造を解明しました。しかし、S46ファミリーにはDAP BIIとは全く異なり負電荷を持つ酸性アミノ酸を認識してペプチドを切断するDPP11という酵素が存在し、歯周病菌の増殖や病原性にDPP11が重要な役割を担っていることが近年明らかになってきました。
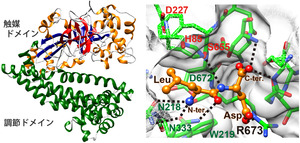
図1 PgDPP11のサブユニット構造(左)と酸性
ペプチドLeu-Asp結合モデル(右)
(左)上側ドメインが触媒ドメイン、下側ドメ
インがペプチダーゼ活性の基盤となる調節
ドメイン。調節ドメインが触媒ドメインの活性
部位を覆っているため、球状タンパク質は活性
部位に接近できず、 ペプチドだけがこの酵素の
基質となる。
(右)PgDPP11を緑、Leu-Aspジペプチドをオレンジ
で示し、触媒残基が赤文字、基質N末端認識残基が
緑文字の部分。
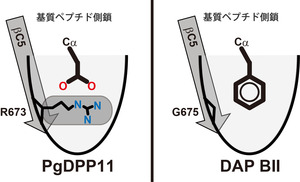
図2:PgDPP11とDAP BIIのペプチド認識部位の比較
PgDPP11では、基質ペプチドのアミノ酸側鎖が結合する
ポケットの途中に正電荷を持つアルギニン側鎖(R673)
が存在するため、負電荷を持つアスパラギン酸やグルタ
ミン側鎖の結合に都合が良い。また、R673によりポケット
の深さが制限されているため、大きいアミノ酸側鎖は結合
できない。一方、DAP BIIのポケットの場合は該当する箇所
がグリシン側鎖(G675)となっているため深いポケットが
形成され、大きい側鎖の結合に適している。
今回、国際宇宙ステーション・「きぼう」日本実験棟にて結晶化したタンパク質の結晶を用い、Porphyromonas gingivalis由来DPP11(PgDPP11)の立体構造をX線回折実験によって決定しました(図1)。その結果、基質結合部位に存在する正電荷を持つアルギニン側鎖(R673)が、基質ペプチドの酸性側鎖の認識に関与していることが明らかとなり、R673の酸性基質認識における重要性が生化学実験でも検証されました。疎水性アミノ酸を認識して切断するDAP BIIでは、その位置がグリシン(G675)となっているため、DPP11とDAP BIIとでは、ポケットの深さが異なることが分かりました(図2)。
これにより、これまでの抗菌薬と異なる新たな作用機序に基づく歯周病原因菌や多剤耐性菌に対する抗菌薬や、歯周病の症状を改善する治療薬の開発が期待できます。現在、研究グループでは、得られた立体構造情報を用いて、PgDPP11の基質結合部位に強く特異的に結合し、PgDPP11の働きを阻害できる化合物の探索を進めています。
今回の実験結果は、「創薬等支援技術基盤プラットフォーム事業」のビームタイム配分により得られたものです。
本成果は、Scientific Reports誌(Nature Publishing Group)の6月9日号に掲載されました。
岩手医科大学発表のプレスリリースはこちら
細菌の性質に応じた分類の一つで、デンプンなどの炭水化物、ブドウ糖を分解してエネルギーを得る大腸菌などの細菌は発酵性細菌に分類され、タンパク質やペプチドを分解してエネルギーを得る細菌が糖非発酵グラム陰性細菌に分類されます。本研究で着目しているS46ペプチダーゼを持つ代表的な糖非発酵グラム陰性細菌には、歯周病原因菌のPorphyromonas gingivalis, Porphyromonas endodontalisや多剤耐性菌のStenotrophomonas maltophiliaなどがあります。