東京大学大学院薬学系研究科の清水敏之教授、張志寛大学院生、大戸梅治准教授、東京大学医科学研究所、大阪大学大学院工学研究科、首都大学東京理工学研究科の研究グループは、微生物の侵入を感知して免疫系を活性化するTLR7タンパク質の詳細な立体構造をフォトンファクトリーAR-NE3AおよびSPring-8を用いて世界で初めて明らかにしました。
細菌やウイルスなどの病原体に対する感染防御機構として、私達の体には自然免疫機構が備わっています。TLR(Toll様受容体)は細胞表面にあるタンパク質で、病原体を感知して免疫作用のスイッチとして機能します。その一つ、TLR7はウイルス由来の一本鎖RNA(polyU)または合成低分子リガンド*1(グアノシン、loxoribine、R848)を感知することで、インターフェロン*2などの産生を促します。そのためTLR7は、抗ウイルス薬、ワクチン、抗がん剤などのターゲットとして注目されていましたが、リガンドを感知する具体的な機構は不明でした。
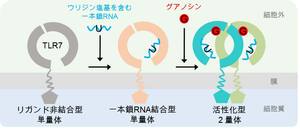
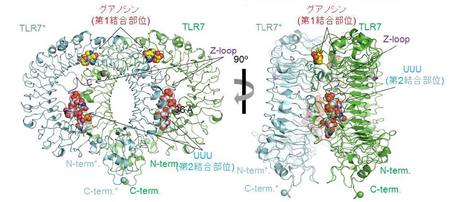
研究グループは、認識機構を調べるためにTLR7-グアノシン-polyU、TLR7-loxoribine-polyU、TLR7-R848、の3つの複合体の立体構造を放射光X線を利用して明らかにしました。その結果、TLRはそれぞれのリガンドと2:2、または2 : 2 : 2の複合体を形成することで活性化型のm字型の2量体構造をとることが分かりました(図1)。さらに詳細に調べていくと、グアノシン、loxoribineおよびR848などの低分子リガンドは2量体の界面に位置する第1結合部位に、polyU一本鎖RNAはTLR7のリング型構造の凹面の第2結合部位にあることも分かりました。
これまでTLR7は一本鎖RNAを認識すると考えられていましたが、今回の結果から2種類のリガンドを同時に認識し活性化することが明らかになりました。これらの知見は、ワクチンアジュバントの開発やウイルス感染やアレルギーなどの治療薬の設計につながることが期待されます。
東京大学発表のプレスリリースはこちら
論文情報
雑誌名:Immunity
タイトル:"Structural analysis reveals that Toll-like receptor 7 is a dual receptor for guanosine and single-stranded RNA"
著者:張志寛、大戸梅治、柴田琢磨、クラユヒナエレナ、田岡万悟、山内芳雄、丹治裕美、礒邉俊明、内山進、三宅健介、清水敏
DOI:10.1016/j.immuni.2016.09.011