理化学研究所の横山構造生物学研究室を中心とする研究グループは、タンパク質 EarPが、タンパク質 EF-Pに糖を付加する新たな仕組みを明らかにしました。 EarPは臨床上重要な病原菌に存在しているタンパク質、EF-Pは様々なタンパク質のスムーズな合成を促す働きを持つタンパク質です。
2016年に理研の横山 茂之 上席研究員らは、敗血症や髄膜炎の原因となる髄膜炎菌について調べ、EarPはEF-Pにラムノースという糖を付加すること(ラムノシル化)、 EarPは髄膜炎菌の正常な増殖に不可欠であることを明らかにしました。
今回、EarPがどのように働くかを詳しく調べるために、大型放射光施設 SPring-8とフォトンファクトリー BL-5Aの放射光を用いて、X線結晶構造解析を行いました。 その結果、EF-Pのラムノシル化される部分がEarPに結合し、幅広い相互作用面積を作ることでEF-Pと相互作用をしていることが分かりました。 さらに、モデリングと分子動力学シミュレーションを用いて、ラムノシル化反応が起こる際、ラムノースの形が反転することで反応が促進されることを明らかにしました。 このような糖の反転を伴う反応の仕組みはこれまで知られておらず、EarPに独特なものといえます。
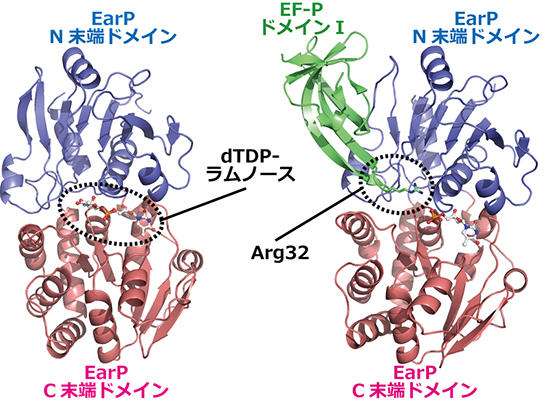
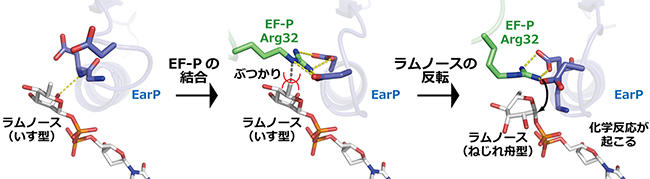
今回の研究で、EarPの特徴的な働き方が詳しく明らかになったことで、EarPの働きを抑える化合物の合理的なデザインが可能になります。 EarPは、髄膜炎菌のほかに淋菌・緑膿菌・百日咳菌などの臨床上重要な病原菌に存在していますが、ヒトにはありません。 そのため、これらの病原菌にのみ効き、耐性菌が出にくく、かつ副作用を生じるリスクが低い新しい抗菌剤の開発につながると期待できます。
本研究は、米国の科学雑誌 Nature Chemical Biology オンライン版(2月13日付け)に掲載されました。
関連情報: