東京大学大学院薬学系研究科の大戸 梅治 准教授、清水 敏之 教授を中心とする研究グループは、 微生物の侵入を感知して免疫系を活性化するToll様受容体9(TLR9)と呼ばれるタンパク質の新しいDNA結合部位を明らかにしました。
細菌やウイルスなど病原体の感染を防ぐ仕組みとして、私たちの体には自然免疫機構が備わっており、タンパク質 TLRは主要な役割を担うセンサーの一つです。 TLR受容体の一種であるTLR9は、微生物由来のDNA配列(CpGモチーフ*)を感知することで、インターフェロン*などの産生を促します。 TLR9は、抗ウイルス薬やアレルギー薬などの創薬の標的として注目されていますが、活性化機構には不明な点が多く残されていました。
*CpGモチーフ: DNA中に存在するシトシンとグアニンがホスホジエステル結合でつながったDNA配列。 哺乳類ではメチル化されることが多いのに対して、細菌やウイルスではメチル化されていない(非メチル化)ことが知られている。 非メチル化CpGモチーフはTLR9を強く活性化してさまざまな免疫応答を引き起こす。
*インターフェロン: 細菌やウイルスなどの病原体の侵入に対して免疫系の細胞が分泌するタンパク質で、ウイルスの増殖を抑制する作用や免疫系を活性化する作用を発揮する。
研究グループは、これまで知られているCpGモチーフ配列を持つDNAに加えて、末端から2番目にシトシンを持つDNAがTLR9の活性化に重要であることを示しました。 大型放射光施設SPring-8およびKEK フォトンファクトリー AR-NE3A の強力なX線を用いて、これらの2種類のモチーフを持つDNAが結合したTLR9のX線結晶構造解析を行った結果、 TLR9、CpGモチーフDNA、5'XCXモチーフDNAは2対2対2の比率で結合し、TLR9は活性化型の二量体構造を形成していることが分かりました。
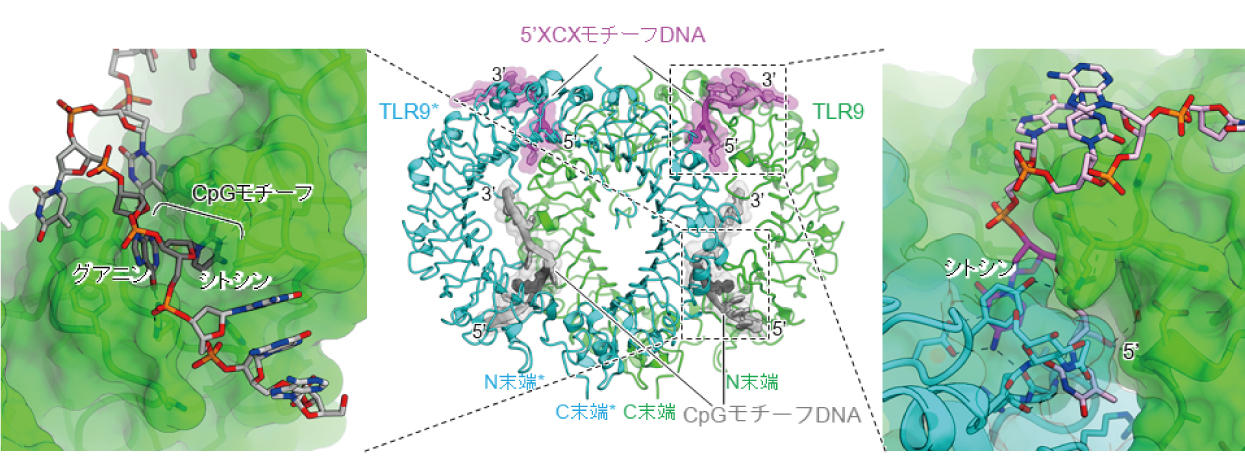
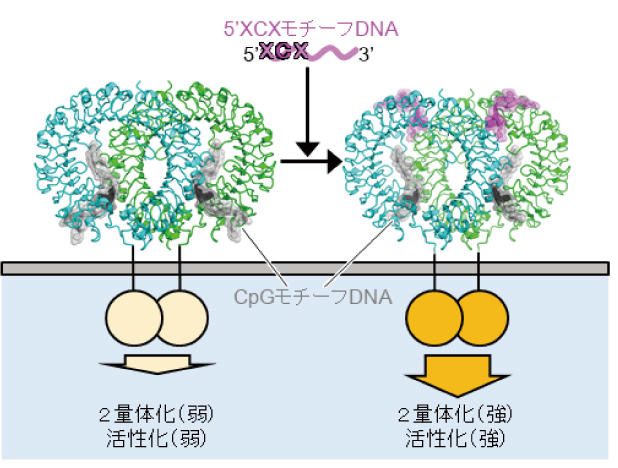
今回のX線結晶構造解析と生化学実験の結果、TLR9が効率的に二量体を形成し活性化する機構が明らかになりました。 今後、抗ウイルス薬、アレルギー薬、ワクチンなどの治療薬の設計につながると期待されます。
本研究成果は4月4日、米国の雑誌Immunityに掲載されました。
関連記事:
関連情報: