タンパク質の結晶構造解析をするにはきれいな結晶を作ることが必須となりますが、
結晶化の最適な条件を新規に見つけるには多くの条件を試さなければならず、結晶構造解析の難関となっています。
徳島大学 先端酵素学研究所の真板 宣夫 准教授は、低分子化合物においてすでに実現されている方法(結晶スポンジ法)をヒントに、
まず空隙の大きい結晶を準備し、その内部に目的のタンパク質を結合させる方法で「ユビキチン」の結晶を得て、その構造を解析しました。
真板 准教授は、目的のタンパク質だけで結晶を作るのではなく、天然に存在する多孔性結晶を作る他のタンパク質を利用することを考えました。
それにはタンパク質が入るのに充分な大きさの孔をもつ結晶格子が必要です。
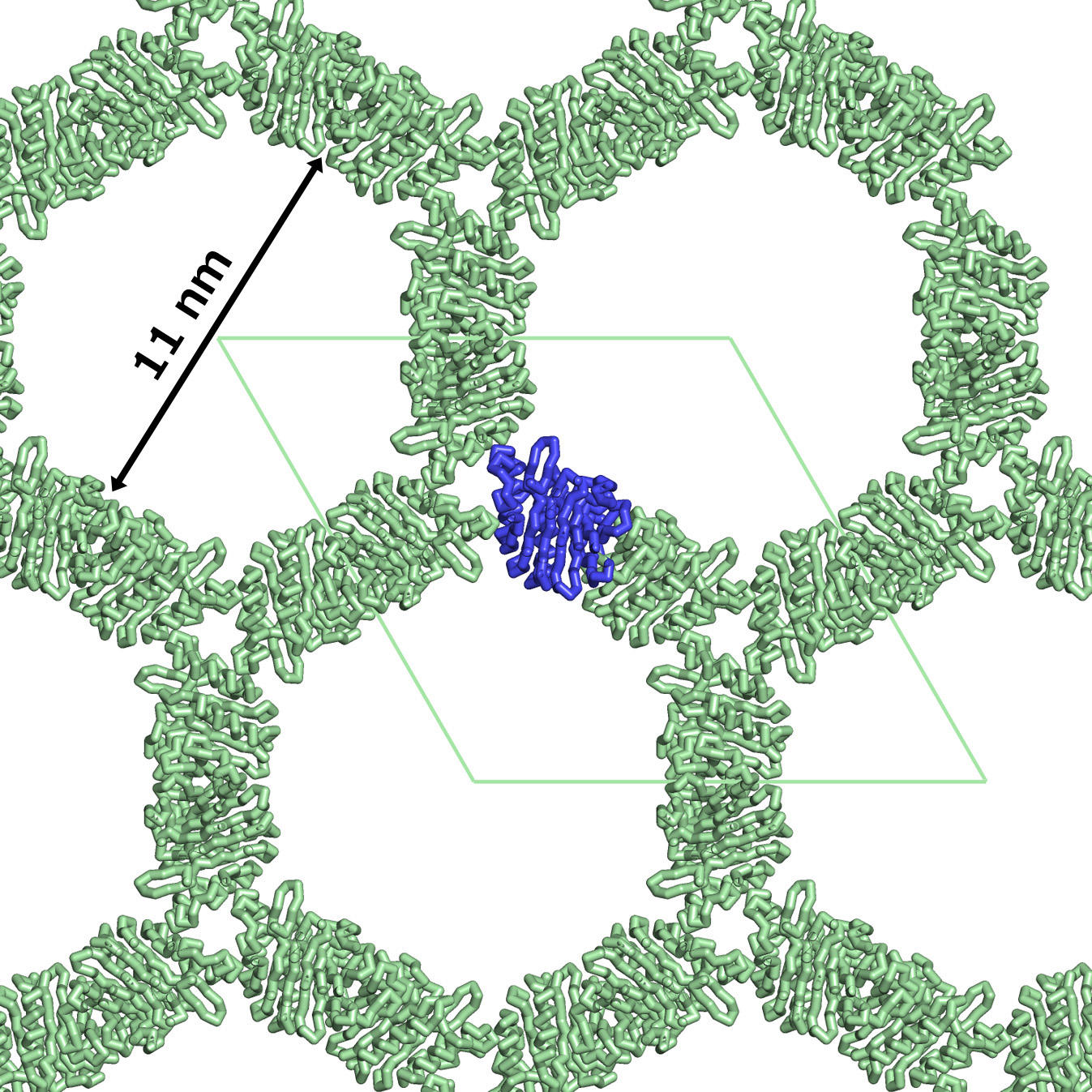
そこで着目したのが、内径 11 nm の孔をもつハニカム構造の結晶を作るR1EN(下図 左)でした。
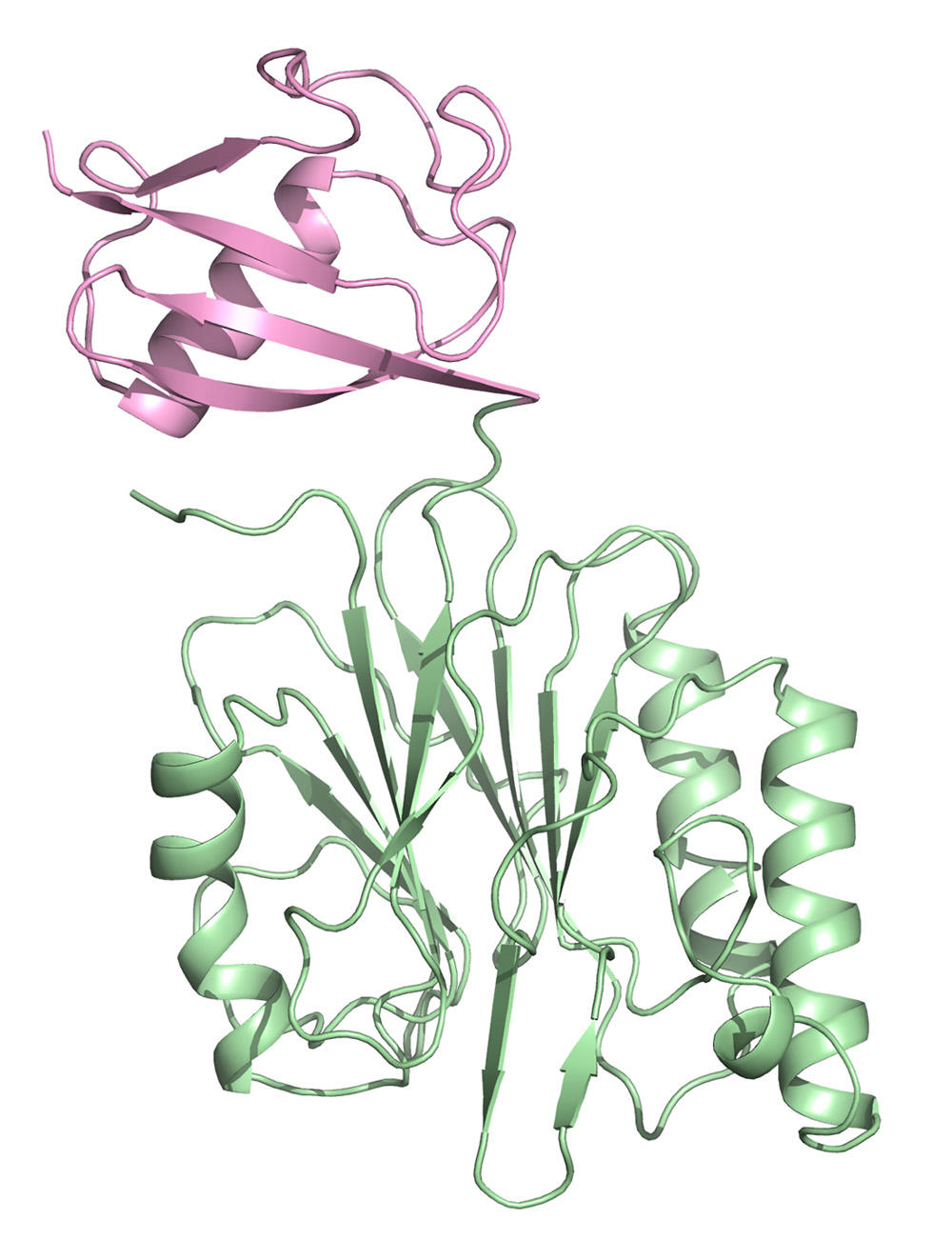
そして、遺伝子工学手法を使い、タンパク質 R1ENの孔に別のタンパク質 ユビキチンを融合させ、孔内部に効率よく結合させることに成功しました。
ユビキチンの溶液にR1ENだけの微結晶を混ぜて種結晶とし、R1EN の結晶化条件のままでR1EN-ユビキチンの結晶が得られたのです。

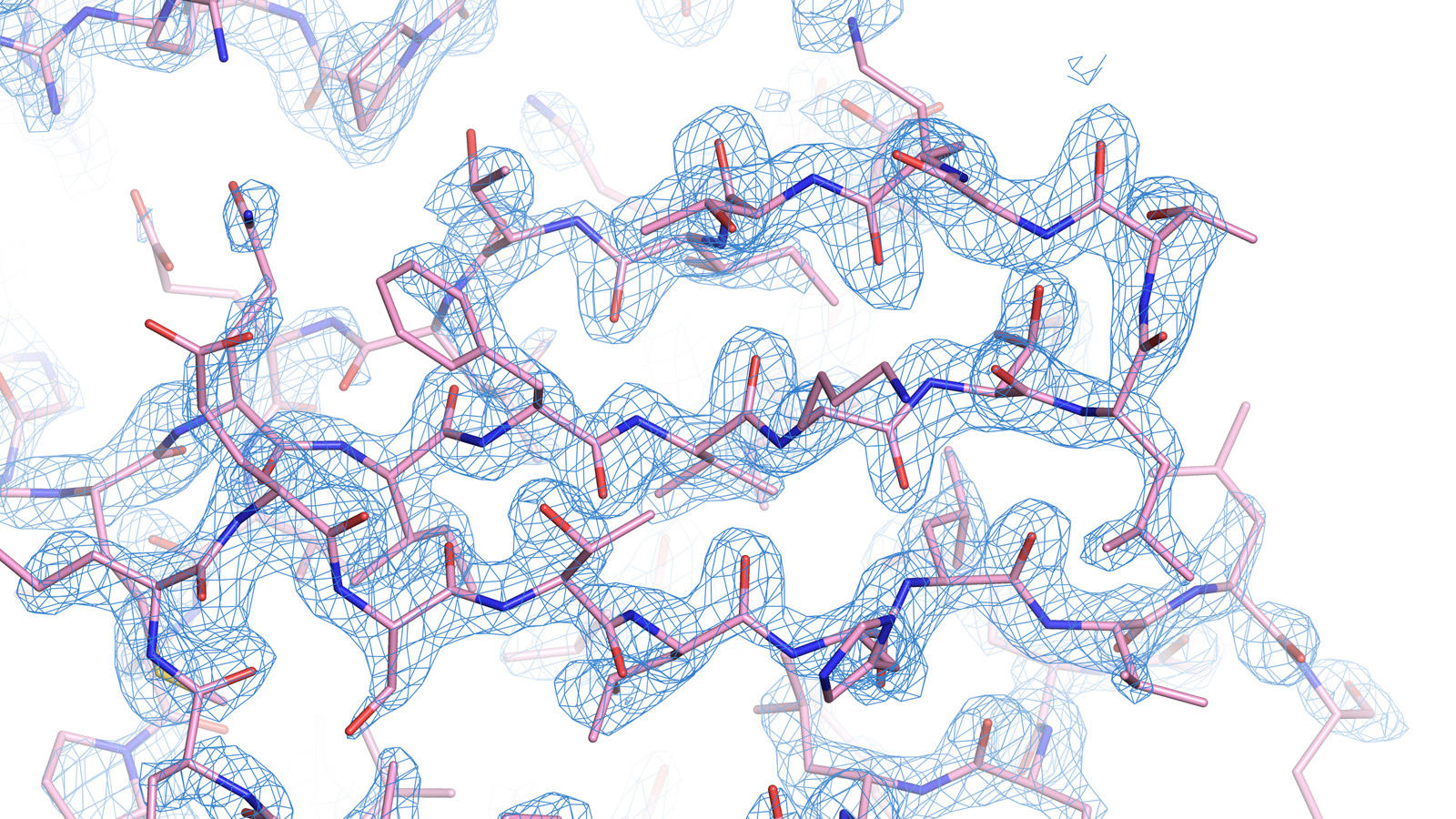
フォトンファクトリー アドバンストリング(PF-AR)NW-12A,フォトンファクトリー(PF)BL-5A,BL-17AおよびSPring-8の放射光を用いて結晶構造を解析したところ、 最高1.7 Åの分解能のデータを取得することができました。PFのこれらのビームラインは、構造生物学研究センターが運用するビームラインです。
放射光実験により得られたデータを、R1ENのみの結晶構造データを用いて解析した結果、ユビキチンのみの構造データが得られました。 このデータを既に報告されているユビキチンの構造データと比較したところ、最大で0.53 Åの違いしか見られず、この方法での構造解析が有効であることが確かめられました。
今後は解析可能なタンパク質の分子量の上限を上げることと、この方法での新規構造のタンパク質を解析することを目指して改良を行う予定です。
論文情報:Nobuo Maita “Crystal Structure Determination of Ubiquitin by Fusion to a Protein That Forms a Highly Porous Crystal Lattice”, Journal of the American Chemical Society,2018.10.9 (web)
関連情報: