富山県立大学 工学部 医薬品工学科の磯貝 泰弘 准教授、立命館大学 生命科学部の今村 比呂志 助教は、長浜バイオ大学、岡山大学、法政大学のグループと共同で、複数の絶滅した祖先クジラのタンパク質の復元に成功しました。
復元に成功したのはミオグロビン(Mb)というタンパク質です。動物の筋肉が赤く見えるのは主にこのタンパク質によるもので、
Mbはヘモグロビンによく似ていますが、ヘモグロビンよりも酸素と結合する力が強く筋肉中で酸素を貯蔵する働きを持ちます。
潜水能力の高いクジラなどの海獣の筋肉組織中には、陸棲動物に比べて数倍から数十倍の濃度のMbが溶け込んでいることが知られています。
このことは長い時間呼吸せずに潜水するには有利ですが、Mb同士がくっついて機能不全になる危険性も伴います。
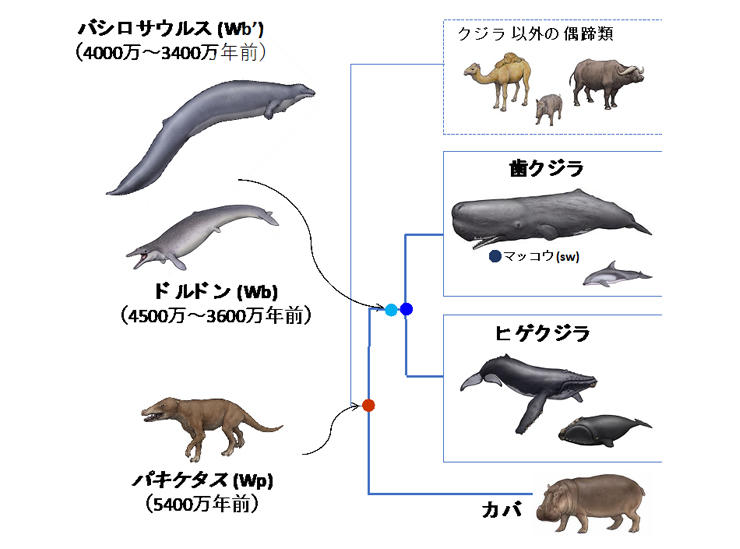
海獣は数千万年かけて、陸上で生活した祖先から海洋での生活に適応するよう進化したと考えられていますが、
Mbがどうやって高濃度での溶解状態と機能を達成したのか、これまで謎となっていました。
研究グループは、現存生物由来グロビン*のアミノ酸配列の統計解析と遺伝子工学・生化学・物理化学・構造生物学実験によって、クジラMbの進化の跡を辿ることにより、この謎を解明しました。 具体的には、陸棲のパキケタスから浅い海に適応したバシロサウルスへの進化の過程で、Mbが細胞内の他の生体分子の影響を受けにくく変化し、さらに深い海に適応した現存クジラに至る過程で、構造安定性が向上し壊れ難くなったことが分かりました。
*グロビン:鉄を含み酸素と結合したり運搬したりするミオグロビンやヘモグロビンなどのタンパク質の総称。
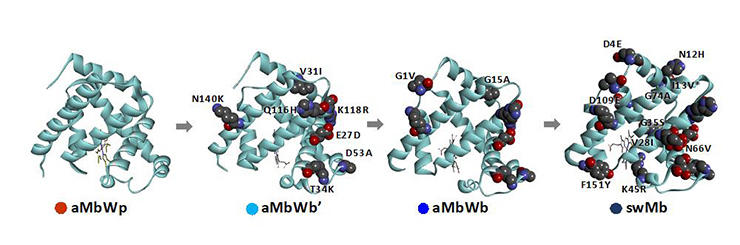
この研究のように、様々な手法を組み合わせて、生物の構造・状態・機能を理解しようとする手法は相関構造解析と呼ばれています。
それぞれの手法の得意とするところを活かして、単独の手法からは到達できない高度な解析結果を導き出します。
例えばこの研究では、
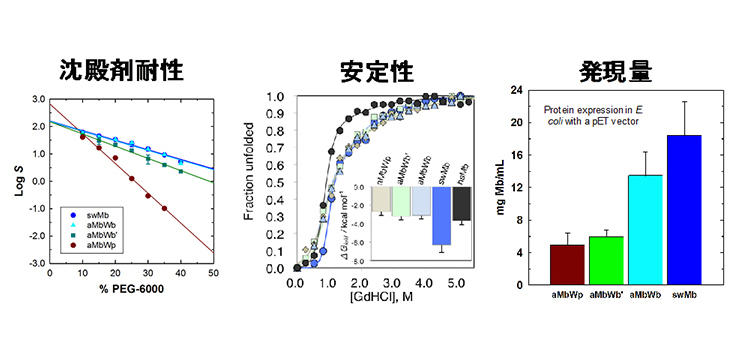
SPring-8を利用した原子レベルの結晶構造解析結果と、フォトンファクトリー BL-10Cでの溶液試料による小角X線散乱法(SAXS)を利用した分子間相互作用の解析結果の組合せにより、
進化の過程でMb同士がくっつきにくくなり高密度状態が可能になったことが明らかになりました。
また、円偏光二色性分光法による変性実験や分子動力学計算(MD)およびSAXSでタンパク質の安定度や構造自由度を評価し、Mbの構造安定性が増し高濃度下でも壊れにくくなったことを確認しました。
さらに、各Mbのタンパク質精製量を比較し、海に適応するほどその量が増えていることも確かめるなどの結果を総合して、クジラMbの進化の跡を辿ることができたのです。
抗体医薬をはじめとするバイオ医薬品は、ガンやリュウマチ等の特効薬として期待されていますが、薬効成分であるタンパク質が不安定で溶解度が低く、生産に多大なコストがかかることが社会問題になっています。本研究の成果を応用することにより、低価格のバイオ医薬品の開発が期待されます。
論文情報:"Tracing whale myoglobin evolution by resurrecting ancient proteins" (祖先型タンパク質の復元によるクジラミオグロビン進化の追跡) 英国 Scientific Reports オンライン版 2018年11月15日公開
関連記事:
関連ページ:PF小角散乱ビームライン