東京大学大学院 薬学系研究科 蛋白構造生物学教室の清水 敏之 教授を中心とする共同研究チームが、クライオ電子顕微鏡分析と放射光によるX線結晶構造解析を併用しTLR7/新規阻害剤の複合体構造を高分解能で解明しました。
生命体は細菌やウイルスなどの病原体の侵入と感染を探知し反撃するため、自然免疫システムという先天的に備わる防御機構を発達させてきました。Toll様受容体(Toll-like receptor, TLR)は多くの動物にある自然免疫受容体の一つであり、自然免疫システムにおいて中心的な役割を果たしています。ヒトでは10種類のTLRが発現されており、そのうちのTLR7は一本鎖RNAの受容体として知られ、ヒト免疫不全ウイルス、インフルエンザウイルスおよびコロナウイルスなどが引き起こす感染症に深く関与しています。
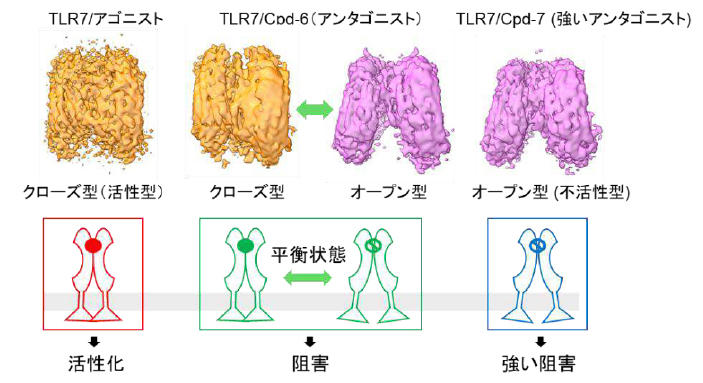
これまでに、本研究グループはTLR7の一本鎖RNAおよび低分子アゴニストによる活性化機構の分子メカニズムを解明してきました。一方、TLR7が誤って自己RNAを認識することが喘息、全身性エリテマトーデス(SLE)および関節リウマチなどの自己免疫疾患の病態形成に関与することが知られています。
近年、TLR7を標的とした自己免疫疾患の分子治療法が世界中の研究グループおよび製薬企業により開発されています。しかし、これらの治療薬候補によるTLR7の阻害機構の分子メカニズムは解明されていません。
そこで、共同研究チームの大日本住友製薬は、TLR7に対する特異的かつ強力な阻害剤であるCpd-6およびCpd-7を創出しました。さらに、Cpd-7の治療効果を評価するため、SLEのマウスに投与した結果、腎炎発症の抑制および生存率の改善が見られました。
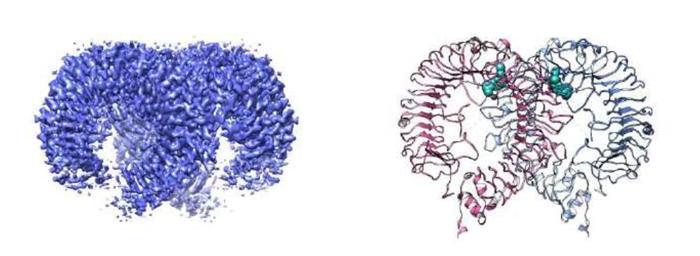
研究グループはKEK物構研 構造生物学研究センター(SBRC)、理化学研究所放射光科学研究センターおよび東京大学Cryo-EM施設のクライオ電子顕微鏡と、フォトンファクトリーでのX線結晶構造解析(PF BL-5AとPF-AR BL-NE3A)を併用して、TLR7が上記の阻害剤による動的な構造変化を引き起こすことを観察しました。これらの結果から、Cpd-6 およびCpd-7により誘導されるTLR7二量体は、安定な活性化状態を保持できず、不活性の阻害状態となると結論付けました(図1)。さらに、TLR7によるCpd-7の認識の分子メカニズムを可視化するため、東京大学Cryo-EM施設の電子顕微鏡を用いて、2.8 Åの高分解能で世界で初めてTLR7/Cpd-7の分子構造を解明しました(図2)。
この研究成果により、TLR7をターゲットとした自己免疫疾患の画期的な治療薬の開発が進むことが期待されます。
関連記事:
関連ページ: