東京大学大学院 薬学系研究科の清水 敏之 教授、丹治 裕美 大学院生、大戸 梅治 准教授、コロラド大学、清華大学の研究グループは、ウィルスや自己由来のRNAを感知して免疫系を活性化するTLR8タンパク質が、阻害剤によって活性化が抑制される機構を、世界で初めて明らかにしました。
自然免疫は病原微生物感染に対する重要な生体防御システムであり、宿主のセンサーが病原体由来分子を認識することで誘導されます。 このようなセンサーの中で中心的な役割を果たすのがToll様受容体(Toll like receptor: TLR)です。 TLR8は一本鎖RNAの受容体であり、TLR8が過度に応答する現象は、自己免疫疾患に関係するとされています。 そのため、TLR8を不活性化する阻害剤は、自己免疫疾患治療薬として期待されていますが、阻害剤がTLR8を不活性化する仕組みは、明らかになっていませんでした。
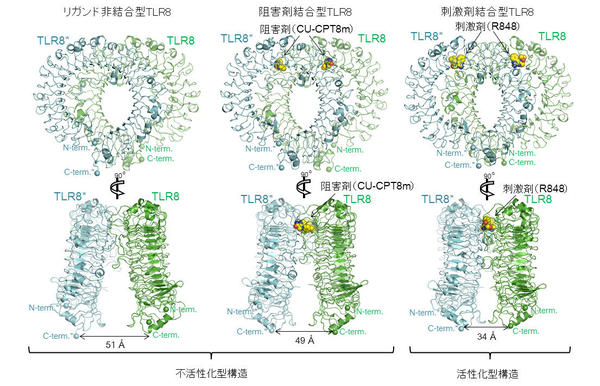
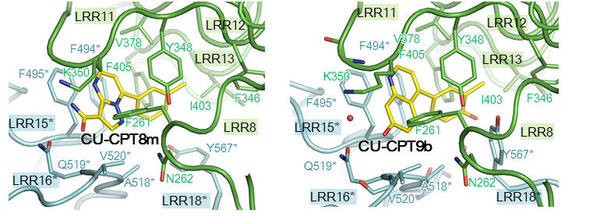
フォトンファクトリーのPF-AR NE3AおよびPF BL-5AにおけるX線結晶解析で、阻害剤(CU-CPT8mおよびCU-CPT9b)とTLR8との複合体の立体構造を調べたところ、 「阻害剤結合型TLR8」は「リガンド非結合型TLR8」と類似した不活性化型2量体を形成していました(図1)。 阻害剤は、不活性化型2量体にのみ存在する結合部位2箇所に結合しており、特徴的な相互作用により認識されていました(図2)。
本研究に用いた2種類の阻害剤は、TLR8の不活性化型2量体構造を安定化することで活性を抑制することが明らかになりました。 本知見は、構造解析によってはじめて得られたものであり、今後TLR8を標的とした自己免疫性疾患治療薬の開発に寄与すると考えられます。
関連情報: