元素は周期表上で炭素(C)、ケイ素(Si)などを含む第14族(下図の黄色の列)より左に行くほど正イオンになりやすく、安定な第18族を除いて右に行くほど負イオンになりやすいという性質を持っています。複数の元素からなる物質では、その性質に従って原子の間で電子のやりとりが起こり、周期表の左寄りの原子は正イオン、右寄りの原子は負イオンの状態を取ります。また、このような電子のやり取りは化学結合の源で、これによって安定な物質が形成されるとともに、電気を流さない状態(絶縁体)になります。
例えば、塩化ナトリウム(NaCl;食塩)では、周期表上の左端にあるナトリウム(Na)から右端にある塩素(Cl)へと電子が1個移動し、ナトリウムは正イオンNa+、塩素は負イオンCl-として存在しています。
では、例えば周期表上で第14族の元素と、第3~11族の遷移金属と呼ばれる元素(下図の水色)を組み合わせると何が起きるでしょうか?遷移金属元素は左にあるため正イオンになりやすいだけでなく、d軌道*と呼ばれる電子殻にある電子を最大7~8個程度放出することができます。一方、第14族の元素では電子は4個までしか出入りできません。そこで、これらの元素の組み合わせでできた物質では、余った電子を保持できるような原子サイズの隙間ができ、そこで電子が負イオンの代役を務めています。そのような隙間にある電子をエレクトライド電子と呼び、それを持つ物質をエレクトライド(電子化物)と呼んでいます。
*d軌道:原子のなかで電子が占める席を電子軌道、その集まりを電子殻と呼びます。電子軌道はエネルギーが低い順にs軌道、p軌道、d軌道と呼ばれ、d軌道はdiffuse(発散・拡散)の頭文字から名付けられました。
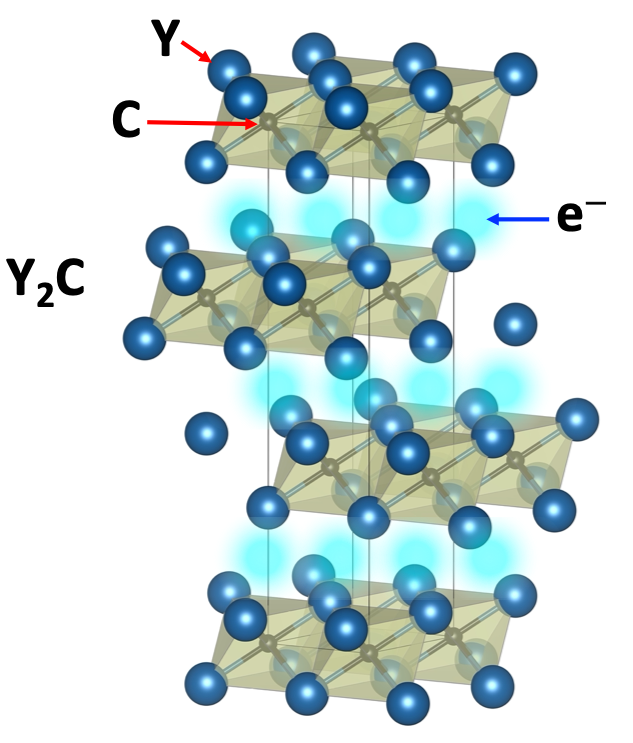
例えばイットリウム(Y)と炭素からなる物質Y2Cでは、CとYからなる四面体の層状構造の隙間にエレクトライド電子が二次元的に広がった状態になります。エレクトライド電子は、原子核に束縛されず格子間を漂っているので電気を運ぶことができます。つまりエレクトライドは金属になります。 また、エレクトライド電子はアルカリ金属と同じように物質の表面から出入りしやすい(仕事関数が小さい)一方で、エレクトライド自体は大気中でも比較的安定という特徴を持ち、発光ダイオードの電子注入層やアンモニア触媒材料などへの応用が進められています。
関連記事:
関連ページ: