生物が生き続けるためには、刻々と変化する外的環境や体内状況に応じて、細胞内の代謝物の量や酵素の活性などを変化させる必要があります。例えば、化学反応の駆動力となるエネルギー分子の量を常にモニターし、その量に応じてエネルギー分子を使う反応の制御を行う必要があります。また、生物の進化に伴って、細胞内で働く分子も進化します。今回の話の主役であるphosphatidylinositol 5-phosphate 4-kinase β(PI5P4Kβ)は、脊椎動物の出現とほぼ同じ頃に進化し、ガン細胞中で大量に消費されているGTPというエネルギー分子の量をモニターするようになりました。今回の研究では、その進化の道筋を解明しました。
GTPはグアノシン三リン酸という分子です。DNAの塩基の一つであるグアニンに、単糖の一種のリボースと3つのリン酸基が結合しています。三リン酸と言えば、アデノシン三リン酸、訳してATPを思い浮かべる方もいらっしゃることでしょう。どちらも細胞内の様々な反応に用いられていることから、エネルギー分子と呼ばれています。
GTPはATPに次いで2番目に多く存在する細胞内のエネルギー分子です。脊椎動物などの高等な生物では、上記の基本的な機能に加えて、複雑な細胞の仕組みを制御する働きも担っています。GTPのセンサーであるPI5P4Kβは細胞膜などに存在する酵素で、GTPからリン酸基(エネルギー)を1つ受け取り、PI5Pという脂質に渡すことで化学反応を進めています。このようにリン酸基をリン酸基供与体から基質に移す酵素をキナーゼと呼びます。通常キナーゼはリン酸基供与体としてATPを使いますが、PI5P4KβはGTPをリン酸基供与体として使うとてもユニークなキナーゼで、GTPの濃度をモニターし、細胞の代謝や増殖を制御するという重要な働きを持っています。
高エネルギー加速器研究機構、東京大学、シンシナティ大学を中心とする共同研究チームはGTPに着目し、GTPの細胞内濃度がどのようにモニターされ細胞内部の働きに影響を与えるのか、10年以上にわたり研究を続けてきました。2016年には下のようなPI5P4Kβ のユニークな働きを見出しています。
(Sumita, Lo, Takeuchi et al., 2016 Mol. Cell, 61, 187-198)(プレスリリース、ハイライト)。
研究チームはGTPを制御することで、がん※1や新型コロナウイルス※2などの疾病の治療にも応用できると考えて研究を続けています。さらに、その後の分子進化学的な解析により、PI5P4KβはATPを利用する通常のキナーゼから進化し、脊椎動物の出現とほぼ時を同じくして細胞内のGTP濃度をモニターする働きを獲得したと考えられるようになりました。しかし、ATPを利用するキナーゼであったPI5P4KβがどのようにGTPを利用するキナーゼに進化し、GTP濃度をモニターするGTPセンサー機能を獲得したのか、その進化の道筋は分かっていませんでした。
今回、高エネルギー加速器研究機構、東京大学、シンシナティ大学、慶応大学、立教大学、星薬科大学、東海大学、関西医科大学の共同研究チームは、生化学、物理化学、構造生物学的手法を駆使することにより、PI5P4Kβが、どのように進化して細胞内のGTP濃度をモニターする機能を獲得したのかを明らかにすることに成功しました。
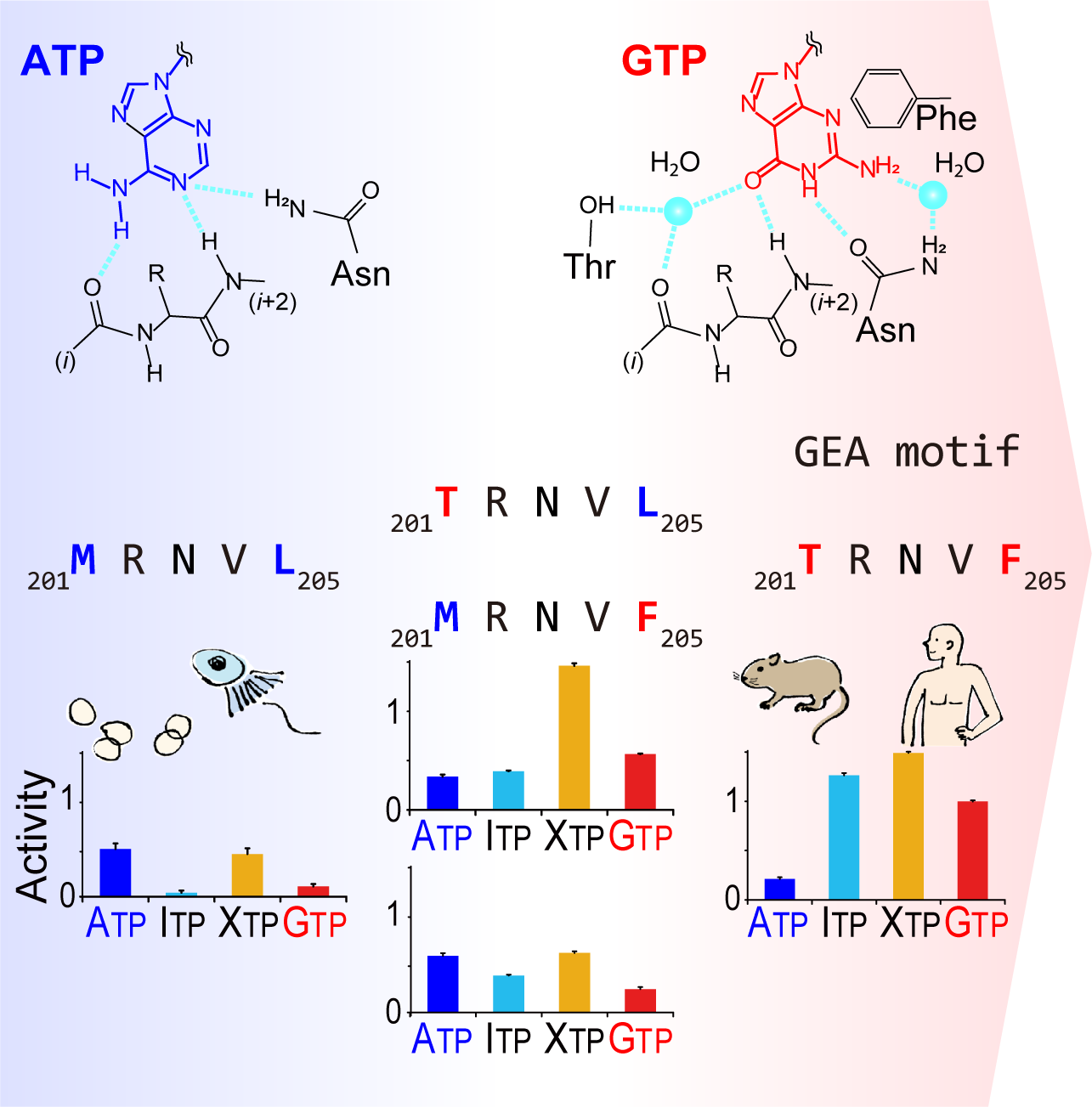 図1 GEAモチーフによるATPおよびGTPの認識とその進化的獲得
図1 GEAモチーフによるATPおよびGTPの認識とその進化的獲得研究チームは、PI5P4KβがGEA (Guanine Efficient-Association) モチーフと名付けた短い配列を獲得することで、GTPの濃度をモニターできるセンサー機能を持つキナーゼに進化したことを明らかにしました(図1上)。さらに、脊椎動物のGEAモチーフ(図1中右)をPI5P4Kβの祖先と考えられているキナーゼの配列(図1中左)へと逆行させてPI5P4Kβの進化の道筋を逆に辿ってみると、GTPセンサー機能の獲得と並行して、元々は利用できなかったITPやXTPなど細胞内にごく僅かに存在するエネルギー分子の利用も可能になっていることがわかりました(図1下右)。
つまり、GTPだけに反応するような理想的な進化をするのではなく、細胞内の量が非常に少ないITPやXTPも同時に利用することを許容し、ATPを利用する能力を下げてGTPをモニターする機能を獲得したことが示唆されます。また、進化的に中間段階にあると考えられる変異体では、ATPを利用する活性は維持されており、祖先型のキナーゼと大きな性質の差がないことがわかります。つまり生物が新たな細胞機能を獲得する際に、元々の機能を失うことによる負の影響を避けながら、新しい機能の探索を行って来たことを示しているようです。言い換えれば、新しい機能を進化させるためには働きを大きく変えない一見無意味に思える変異の積み重ねも大切であることを示唆しています。
この研究成果は、2022年5月2日アメリカ東部時間11時にStructure誌にオンライン発表されました(doi: 10.1016/j.str.2022.04.004)。研究成果は、Structure誌の表紙にも採用されています。プリント版は2022年7月7日に発行予定です。
※1 次世代がん医療創生研究事業 標的探索研究タイプ 研究領域A(治療ターゲット)「増殖ストレス緩和システムを標的とする新規がん治療戦略の確立」
研究開発代表者:慶應義塾大学 佐々木 敦朗 特任教授
https://www.amed.go.jp/koubo/01/03/0103C_00018.html
※2 コロナ基盤「GTP代謝制御によるウイルス複製阻害技術の開発」
研究代表者:高エネルギー加速器研究機構 千田 俊哉 教授
https://www.jst.go.jp/kisoken/crest/project/1111111/1111111_2020.html