昭和大学薬学部の田中 信忠 准教授、梅田 知伸 助教らは、独国ハインリッヒハイネ大学デュッセルドルフのトーマス クルツ教授らとの共同研究により、抗マラリア薬の標的酵素PfIspCと新規阻害剤が結合した立体構造をフォトンファクトリーのX線回折により明らかにしました。
マラリアは、ハマダラ蚊を媒介としたマラリア原虫を病原体とした感染症。世界中で毎年3億?5億人が感染し、100万?300万人が死亡していると言われています。その大部分はサハラ以南のアフリカにおける5歳以下の子供で、少なく見積もっても30秒に1人という恐るべきペースで子供達の命が奪われていることになります。
田中准教授らのグループは、ヒトに影響を与えずに病原体だけに大きなダメージを与えるため、ヒトに存在しない「非メバロン酸経路」という代謝経路を標的とした抗マラリア薬の開発に取り組んでいます。2011年には、既存の抗マラリア薬候補化合物ホスミドマイシンが標的酵素PfIspCに結合する様子を原子レベルで解明しました。しかし、ホスミドマイシンは、親水性が高いため経口投与時の吸収率(生体利用効率)が低いという欠点がありました。クルツ教授のグループでは、ホスミドマイシン類似化合物に疎水性置換基を導入することにより、ホスミドマイシンと同等かそれ以上のPfIspC阻害活性があり、かつ生体利用効率が改善された化合物群の合成に近年成功しました。
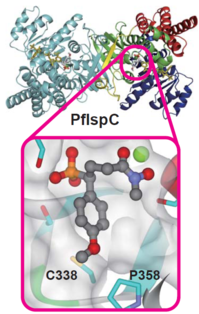
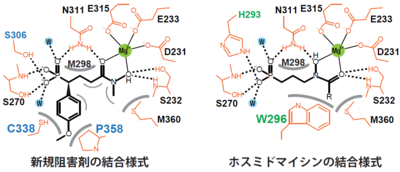
今回、日本、ドイツ、ガボンの共同研究グループは、PfIspCと新規阻害剤3種類の複合体の立体構造をX線回折実験によって決定しました(図1)。その結果、新規阻害剤に導入された芳香性置換基は、PfIspCのサブユニットのコア部分に位置するシステイン338(C338)およびプロリン358(P358)と相互作用していることが分かりました(図2)。この結合様式は、PfIspCとホスミドマイシンの結合様式とは明らかに異なるものでした。また、十分な解像度の電子密度図から、鏡像異性体混合物として合成される阻害剤のうち、S体だけがPfIspCに選択的に結合することも明らかとなりました。右手と左手の関係にある鏡像異性体のどちらが実際に阻害剤として働くのかは、医薬品開発において極めて重要であり、阻害剤のさらなる構造最適化が期待されます。
本成果はアメリカの科学雑誌Journal of Medicinal Chemistryの11月13日号に掲載されました。
論文タイトル "Binding Modes of Reverse Fosmidomycin Analogs toward the Antimalarial Target IspC." [doi: 10.1021/jm500850y]